Содержание
- 2. План 1. Сущность гравиметрического анализа. Классификация методов гравиметрического анализа. 2. Основные этапы гравиметрического определения. Выбор и
- 3. 1. Сущность гравиметрического анализа. Классификация методов гравиметрического анализа. В гравиметрическом анализе используется прямое определение массы вещества
- 4. Гравиметрический метод анализа основан на законах: сохранения массы вещества при химических превращениях; постоянства состава; законе эквивалентов.
- 5. Оборудование Стаканы. В гравиметрическом методе анализа применяют химические стаканы различной вместимости. Для осаждения кристаллических осадков обычно
- 6. Тигли. Фарфоровые тигли применяют для высокотемпературного прокаливания осадков. Фарфоровые тигли можно нагревать до температур не выше
- 7. Эксикаторы применяют для охлаждения тиглей при доведении их массы до постоянного значения, а также для хранения
- 9. Гравиметрический (весовой) метод анализа основан на измерении массы определяeмoгo компонента после его выделения в виде гравиметрической
- 10. В гравиметрическом анализе используют следующие методы: Осаждения, отгонки (прямая и косвенная), выделения, термогравиметрию, электрогравиметрию.
- 11. В методе осаждения определяемый компонент вступает в химическую реакцию с реагентом, образуя малорастворимое соединение. После проведения
- 12. 2) Методы отгонки основаны на выделении исследуемого компонента в виде летучего соединения, чаще всего под воздействием
- 13. 3) Методы выделения основаны на количественном выделении определяемого компонента из анализируемого раствора путем химической реакции с
- 14. 4) В термогравиметрическом анализе фиксируют изменение массы вещества в процессе нагревания, что позволяет судить о происходящих
- 15. 2. ВЫБОР МАССЫ НАВЕСКИ В ГРАВИМЕТРИИ. Точность анализа зависит как от массы навески, так и от
- 16. Относительная ошибка ε взвешивания на аналитических весах определяется соотношением (1): ε =∆т ·100% / т, (1)
- 18. В соответствии с изложенным выше (осадок аморфный) задаваемую массу гравиметрической формы примем равной т(Fе2О3) = 0,1
- 19. Взвешивание (взятие) навески Взвешивание исходной навески анализируемого вещества проводят на аналитических весах с погрешностью взвешивания, чаще
- 20. Взятие навески 1. Берут чистый бюкс, маркируют его графитовым карандашом на пришлифованной части и помещают в
- 21. Растворение навески анализируемого вещества Для растворения навеску анализируемого вещества переносят (т. е. осторожно пересыпают) в чистый
- 22. Разложение малорастворимых неорганических веществ. Разложение пробы малорастворимого неорганического вещества осуществляют «мокрым» путем (действием кислот) или «сухим»
- 23. 4.Требования, предъявляемые к осадителю. Расчет объема осадителя. Осадитель должен быть специфичен, т.е. он должен осаждать данный
- 24. Требования, предъявляемые к осадителю 3. Осадитель должен образовывать осадок с максимально малой растворимостью, т.е. с малым
- 25. Требования, предъявляемые к осадителю 4. При выборе осадителя нужно точно рассчитывать необходимый избыток осадителя, т.к. при
- 26. К важнейшим неорганическим осадителям относятся растворы HCl, H2SО4, Н3РО4, NaOH, NН3, АgNО3, BaCl2, (NH4)2C2О4, (NH4)2HPО4 и
- 27. Преимущества органических осадителей, образующих с катионами металлов устойчивые внутрикомплексные соединения, по сравнению с неорганическими осадителями. l)
- 28. Расчет объема раствора осадuтеля Расчет объема раствора осадuтеля проводят, исходя из требуемого количества осадителя и его
- 29. При прибавлении раствора осадителя к анализируемому раствору серной кислоты выделяется белый мелкокристаллический осадок сульфата бария (осаждаемая
- 30. В 1000 мл 0,2 моль/л раствора BaCl2 содержится 0,2 моля BaCl2 В V(BaCI2) мл 0,2 моль/л
- 31. 4. ОАЖДЕНИЕ (ПОЛУЧЕНИЕ ОСАЖДАЕМОЙ ФОРМЫ). ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К ОСАЖДАЕМОЙ ФОРМЕ. В гравиметрическом методе осаждения существуют понятия
- 32. Осаждение. Факторы, влияющие на полноту осаждения осадка Количество осадителя Солевой эффект Наличие посторонних ионов в растворе
- 33. Осаждение. Факторы, влияющие на полноту осаждения осадка 3. Температура раствора При увеличении температуры от 100 до
- 34. Осаждение. Факторы, влияющие на полноту осаждения осадка 4. Кислотность раствора Величина рН раствора сильно влияет на
- 35. Осаждение. Факторы, влияющие на полноту осаждения осадка 5. Образование коллоидных систем Такие осадки, как Al(OH) 3,
- 36. Кристаллические осадки. При образовании кристаллических осадков выделение вещества из раствора идет на поверхности уже образовавшихся зародышей,
- 37. Аморфные осадки При образовании аморфных осадков в первый же момент слияния растворов образуется большое количество зародышевых
- 38. Аморфные осадки Процессы, происходящие при образовании аморфных осадков Коагуляция - слипание мелких частиц в крупные агрегаты
- 39. Условия образования аморфных осадков : Обязательное присутствие электролита-коагулятора (соли аммония и кислоты). Осаждение из концентрированных растворов
- 40. Требования, предъявляемые к осаждаемой форме (ОсФ): 1. Осадок должен быть не растворим. В растворе после осаждения
- 41. 6.Загрязнение осадков Соосаждение - попадание в осадок посторонних компонентов, содержащихся в растворе, которые сами по себе
- 42. Загрязнение осадков Различают следующие виды соосаждения: адсорбцию, изоморфизм, окклюзию и послеосаждение. 1. Адсорбция - поглощение примесей
- 43. Загрязнение осадков 2. Окклюзия - механический захват примесей при образовании осадка. Окклюдированные вещества находятся внутри частиц
- 44. Загрязнение осадков Механический захват примесей маточного раствора и молекул растворителя характерен для образования аморфных осадков
- 45. Загрязнение осадков 3. Образование смешанных (изоморфных) кристаллов (изоморфное соосаждение) Причина изоморфизма – близость величин зарядов и
- 46. Загрязнение осадков 4. Последующее осаждение - это процесс перехода примесей в осадок при длительном контакте с
- 47. 7. Фильтрование и промывание осадков Фильтрование – отделение твердой фазы осадка от маточного раствора. Для ускорения
- 48. Фильтрование и промывание осадков Промывание – очищение осадка от остатков маточного раствора и сорбированных примесей. Промывная
- 49. Высушивание и прокаливание осадков Условия выбирают на основании термогравиметрических исследований (анализ термограммы). Продолжительность устанавливают экспериментально (до
- 50. 8. ГРАВИМЕТРИЧЕСКАЯ ФОРМА. ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К ГРАВИМЕТРИЧЕСКОЙ ФОРМЕ. Гравиметрической (весовой) формой (ГФ) называют соединение, которое взвешивают.
- 51. Требования, предъявляемые к гравиметрической форме (ГФ) : 1. Состав гравиметрической формы должен точно соответствовать определенной стехиометрической
- 53. F рассчитывается по формуле F = пМ(Х)/М(г.ф.) как отношение молярной массы М(Х) определяемого компонента Х к
- 54. Погрешности гравиметрического анализа Причины систематических погрешностей: -потери от растворимости (неправильный выбор промывной жидкости или фильтра); -неполное
- 56. 10. Применение гравиметрического анализа. Гравиметрический анализ – один из наиболее универсальных методов. Он применяется для определения
- 57. 11. Достоинства и недостатки гравиметрии Достоинства : 1). Высокая точность анализа. Обычная погрешность гравиметрического определения составляет
- 59. Скачать презентацию























































 Первые фотоаппараты
Первые фотоаппараты Малые архитектурные формы МАФ. Стили и концепция
Малые архитектурные формы МАФ. Стили и концепция Мотивация и лидерство на предприятиях бережливого производства
Мотивация и лидерство на предприятиях бережливого производства Проблемы трудоустройства молодых специалистов в России
Проблемы трудоустройства молодых специалистов в России Project: Global Social Media PlanTopic:Traffic Light Beetle Subline: An interactive game showing the range of colourful Beetle
Project: Global Social Media PlanTopic:Traffic Light Beetle Subline: An interactive game showing the range of colourful Beetle Реалізація програмного комплексу ip-телефонії на основі PBX Asterisk
Реалізація програмного комплексу ip-телефонії на основі PBX Asterisk Короткие и длинные волны на воде
Короткие и длинные волны на воде Physical Hardware Layout
Physical Hardware Layout Проекты систем диспетчеризации жилых домов
Проекты систем диспетчеризации жилых домов Десять основных положений нового закона Об образовании в РФ
Десять основных положений нового закона Об образовании в РФ Цитомегалоловирустар, хламидиялық герпестік инфекция және жүктілік
Цитомегалоловирустар, хламидиялық герпестік инфекция және жүктілік Интерфейс передачи сообщений MPI
Интерфейс передачи сообщений MPI Сфинксы. 10 класс
Сфинксы. 10 класс Характеристики камеры
Характеристики камеры Презентация Органические вещества
Презентация Органические вещества Игра Собери портфель
Игра Собери портфель Флора и фауна озера Байкал
Флора и фауна озера Байкал Тайны магических квадратов
Тайны магических квадратов Основные понятия информационных технологий
Основные понятия информационных технологий Фразеологизмы. Что это? Как их понять?
Фразеологизмы. Что это? Как их понять? Настройка репликации на Microsoft SQL Server 2005 Standard
Настройка репликации на Microsoft SQL Server 2005 Standard Фронтальное занятие с детьми старшей логопедической группы по лексической теме Продукты питания
Фронтальное занятие с детьми старшей логопедической группы по лексической теме Продукты питания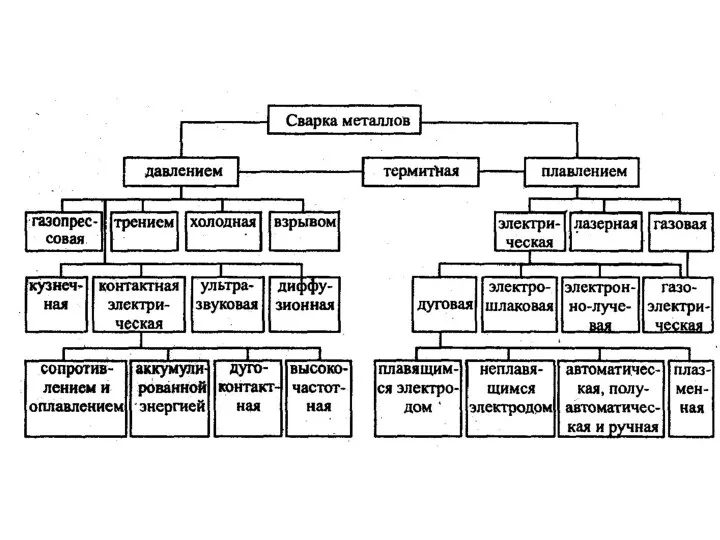 Сварка металлов
Сварка металлов Темперамент. Тема 6
Темперамент. Тема 6 Методы активизации поиска решений нестандартных задач. Формализованные методы генерации идей
Методы активизации поиска решений нестандартных задач. Формализованные методы генерации идей Повесть о житии и о храбрости благоверного и великого князя Александра Невского
Повесть о житии и о храбрости благоверного и великого князя Александра Невского Флористика. Коллаж из природного материала
Флористика. Коллаж из природного материала Презентация ко Дню Героев России
Презентация ко Дню Героев России