- Главная
- Без категории
- Химик реакцияләр.

Содержание
- 2. Химик реакция (Химическая реакция или химическое явление) – бирелгән матдәләрнең бүтән үзлекләргә ия булган башка матдәләргә
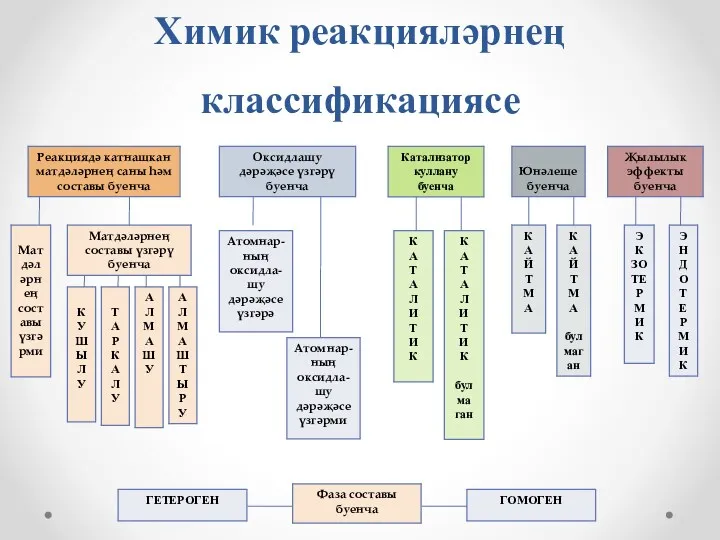
- 6. Химик реакцияләрнең классификациясе
- 9. FeCl3 + 3NaOH →Fe(OH)3 ↓ + 3 NaCl молекуляр тигезләмә Fe3+ + 3Cl- +3Na+ + 3OH-
- 11. Алгоритм записи метода электронного балланса. Составить схему реакции. Определить, атомы каких элементов изме-няют степени окисления. Составить
- 14. Гидролиз
- 15. Na2CO3 1 баскыч: Гидролиз тигезләмәсе кыскартылгын ионлы формада: CO32- + H2O ↔ HCO3- + OH- Гидролиз
- 16. Биремнәрне башкарыгыз: 1. Химик реакция булып тора: а) шәм януы; б) бензинның очуы; в) бозның эрүе;
- 17. Дөрес җаваплар:
- 19. Скачать презентацию
Химик реакция
(Химическая реакция или химическое явление) –
бирелгән матдәләрнең бүтән
Химик реакция
(Химическая реакция или химическое явление) –
бирелгән матдәләрнең бүтән
( процесс, в результате которого из одних веществ образуются другие вещества, отличающиеся от исходных по составу или строению, а следовательно, и по свойствам).
Мисал:
Химик реакцияләрнең классификациясе
Химик реакцияләрнең классификациясе
FeCl3 + 3NaOH →Fe(OH)3 ↓ + 3 NaCl молекуляр тигезләмә
Fe3+ +
FeCl3 + 3NaOH →Fe(OH)3 ↓ + 3 NaCl молекуляр тигезләмә
Fe3+ +
Fe3+ + 3OH- →Fe(OH)3 ↓ кыскартылган ионлы тигезләмә
BaCl2 + H2SO4 → Ba SO4↓+ 2HCl молекуляр тигезләмә
Ba2+ + 2Cl- + 2H+ + SO42-→Ba SO4↓+2H++ 2Cl- тулы ионлы тигезләмә
Ba2+ + SO42- →Ba SO4↓ кыскартылган ионлы тигезләмә
CuSO4 + 2NaOH → Cu(OH)2 ↓ + Na2SO4 молекуляр тигезләмә
Cu2+ + SO42- + 2Na+ +2OH- → Cu(OH)2 ↓+ 2Na++ SO42- тулы ионлы тигезләмә
Cu2+ +2OH- → Cu(OH)2 ↓ кыскартылган ионлы тигезләмә
Җавап:
Алгоритм записи метода
электронного балланса.
Составить схему реакции.
Определить, атомы каких элементов
Алгоритм записи метода
электронного балланса.
Составить схему реакции.
Определить, атомы каких элементов
Составить электронные уравнения про-цессов окисления и восстановления.
В электронных уравнениях подобрать такие коэффициенты ,чтобы число электронов, которые отдает восстановитель, было равно числу электронов, которые присоединяет окислитель.
Перенести эти коэффициенты в схему реакции, затем подобрать коэффициенты перед формулами других веществ реакции.
Окисление (оксидлашу) –
это процесс отдачи электронов.
0 +2
Cu – 2 e = Cu
При окислении степень окисления
элемента повышается, а элемент является
восстановителем.
Восстановление (кайтарылу) - это процесс присоединения электронов.
+2 0
Hg + 2 e = Hg
При восстановлении степень окисления
элемента понижается, а элемент является
окислителем.
Гидролиз
Гидролиз
Na2CO3
1 баскыч: Гидролиз тигезләмәсе кыскартылгын ионлы формада: CO32- + H2O
Na2CO3
1 баскыч: Гидролиз тигезләмәсе кыскартылгын ионлы формада: CO32- + H2O
Гидролиз тигезләмәсе ионлы формада: 2Na+ + CO32- + H2O ↔ Na+ + HCO3- + Na+ + OH-
Гидролиз тигезләмәсе молекуляр формада: Na2CO3 + H2O ↔ NaHCO3 + NaOH
Тирәлек селтеле (pH > 7)
2 баскыч: HCO3- + H2O ↔ H2CO3 + OH-
Na+ + HCO3- + H2O ↔ H2CO3 + Na+ + OH-
NaHCO3 + H2O ↔ H2CO3 + NaOH
AlCl3
1 баскыч: Al3+ + H2O ↔ AlOH2+ + H+
Al3+ + 3Cl- + H2O ↔ AlOH2+ + 2Cl- + H+ + Cl-
AlCl3+ H2O ↔ AlOHCl2 + HCl
Тирәлек әче (pH < 7)
2 баскыч: AlOH2++ H2O ↔ Al(OH)2++ H+
AlOH2++ 2Cl- + H2O ↔ Al(OH)2++ Cl- + H++ Cl-
AlOHCl2 + H2O ↔ Al(OH)2 Cl + HCl
3 баскыч: бармый.
KCl
көчле нигез һәм көчле кислотадан ясалган тоз. Гидролиз бармый. Тирәлек нейтраль (pH = 7)
Биремнәрне башкарыгыз:
1. Химик реакция булып тора: а) шәм януы; б) бензинның
Биремнәрне башкарыгыз:
1. Химик реакция булып тора: а) шәм януы; б) бензинның
Алмашу реакциясенә мисал булып тора: а) CaO + SiO2 → CaSiO3; б) FeS + 2HCl → FeCl2 + H2S;
в) 2KClO2 →2KCl + 3O2; г) C + O2 → CO2
3. Утырым барлыкка килә: а) бакыр (II) нитраты + хлорид кислотасы; б) тимер (III) сульфаты + барий хлориды;
в) кальций карбонаты +натрий нитраты; г) нитрат кислотасы +алюминий фосфаты.
Метилоранж алсу төскә керә: а) натрий сульфиты эремәсендә; б) хлорид кислотасы эремәсендә;
в) аммиакның судагы эремәсендә; г) калий хлориды эремәсендә.
5. Кислота эремәләрен суга салу зарур, ә киресенчә түгел. Бу фикер:
а) дөрес түгел; б) дөрес; в) аларны кушарга ярамый.
6. Туры китерегез: матдәнең исеме гидролиз тибы
А) алюминий сульфиды; 1) катион буенча
Б) натрий сульфиды; 2) анион буенча
В) магний нитраты; 3) катион һәм анион буенча.
Г) калий сульфиты.
7. Туры китерегез: реакция схемасы оксидлашу дәрәҗәсе үзгәрү
А) FeCl3 +HI → FeCl2 + I2 + HCl 1) Fe+3→ Fe+2
Б) KClO4 →KCl + O2 2) 2I- → I20
3) Fe+2 → Fe+3
4) Cl+7 → Cl-
8. Дөрес фикерләрне сайлап алыгыз:
а) химия кабинетында барлык әйбер белән дә кызыксынып, иснәп, тәмен татып карага кирәк;
б) кулга яки киемгә селте тисә, суны күп агызып, бу урынны кичекмәстән юдырырга кирәк;
в) спиртовка ялкынын өреп сүндерергә зарурлыгын истән чыгармаска кирәк;
г) җылытканда пробирка авызын күршегездән читкә юнәлтергә кирәк.
Дөрес җаваплар:
Дөрес җаваплар:















 Презентация к уроку Спирты
Презентация к уроку Спирты Балалардың жүйке іс әрекеттерінің дамуын бағалау
Балалардың жүйке іс әрекеттерінің дамуын бағалау Учимся готовить: десерт Клубничка
Учимся готовить: десерт Клубничка Интеллектуальная система технического зрения для мониторинга состояния и содержания сельскохозяйственных животных
Интеллектуальная система технического зрения для мониторинга состояния и содержания сельскохозяйственных животных Презентационные материалы к аттестации заместителя директора по воспитательной работе
Презентационные материалы к аттестации заместителя директора по воспитательной работе Презентация Молоко и молочные продукты
Презентация Молоко и молочные продукты Презентация Применение ПАВ
Презентация Применение ПАВ Детёныши животных
Детёныши животных Архитектура параллельных вычислительных систем. Часть 1. История и проблематика. Основы параллельного программирования
Архитектура параллельных вычислительных систем. Часть 1. История и проблематика. Основы параллельного программирования Сахарный диабет при беременности, в родах и послеродовом периоде
Сахарный диабет при беременности, в родах и послеродовом периоде Развивающее обучение
Развивающее обучение Управление риском
Управление риском ФГОС дошкольного образования.
ФГОС дошкольного образования. Дербес компьютер. Компьютердің құрылысы
Дербес компьютер. Компьютердің құрылысы Отчет по прохождению производственной практики
Отчет по прохождению производственной практики Напряженность электростатического поля. Линии напряженности электростатического поля
Напряженность электростатического поля. Линии напряженности электростатического поля Кто хочет стать миллионером. Он-лайн игра
Кто хочет стать миллионером. Он-лайн игра Двигательная активность детей в группе
Двигательная активность детей в группе Тез үдемелі гломерулонефрит
Тез үдемелі гломерулонефрит Презентация Оптимизация образовательного процесса за счет интеграции разных видов деятельности
Презентация Оптимизация образовательного процесса за счет интеграции разных видов деятельности Микропроцессорная система зажигания
Микропроцессорная система зажигания Вводные слова и предложения
Вводные слова и предложения Элементарная трудовая деятельность и начальные формы учебной деятельности в дошкольном возрасте
Элементарная трудовая деятельность и начальные формы учебной деятельности в дошкольном возрасте Тема: Здоровый образ жизни.
Тема: Здоровый образ жизни. Центр мониторинга социальных сетей
Центр мониторинга социальных сетей Метаболизм липидов. Липолиз. Окисление жирных кислот и глицерола
Метаболизм липидов. Липолиз. Окисление жирных кислот и глицерола Ярославское высшее военное училище противовоздушной обороны
Ярославское высшее военное училище противовоздушной обороны Презентация по педагогическому познавательно-творческому проекту на тему: Осень золотая
Презентация по педагогическому познавательно-творческому проекту на тему: Осень золотая