Содержание
- 3. 2. Капиллярные явления
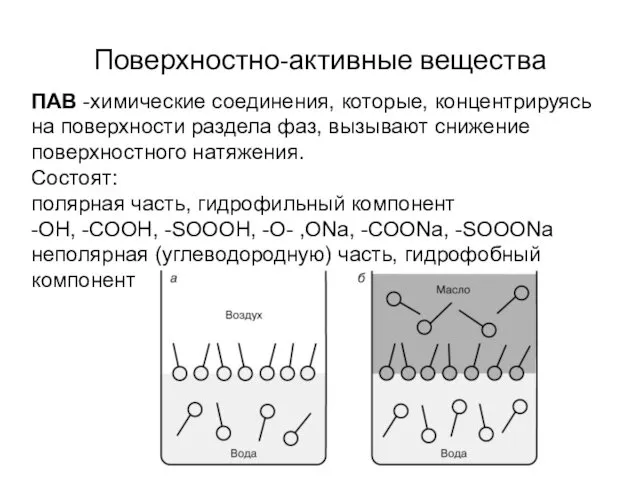
- 5. Поверхностно-активные вещества ПАВ -химические соединения, которые, концентрируясь на поверхности раздела фаз, вызывают снижение поверхностного натяжения. Состоят:
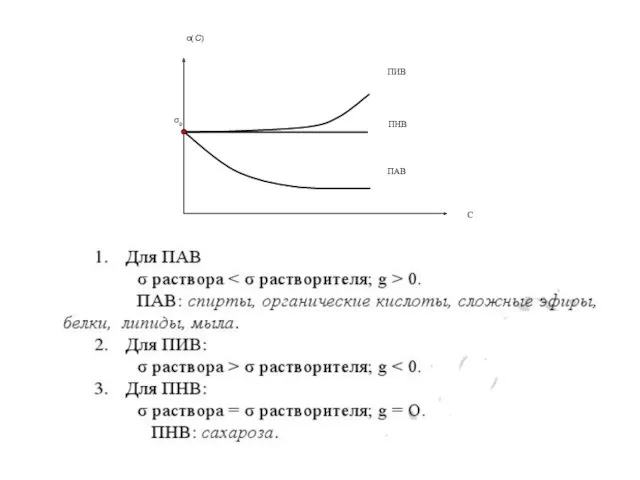
- 7. Уменьшение поверхностного натяжения и, следовательно, поверхностной энергии происходит в результате адсорбции ПАВ на поверхности раздела жидкость
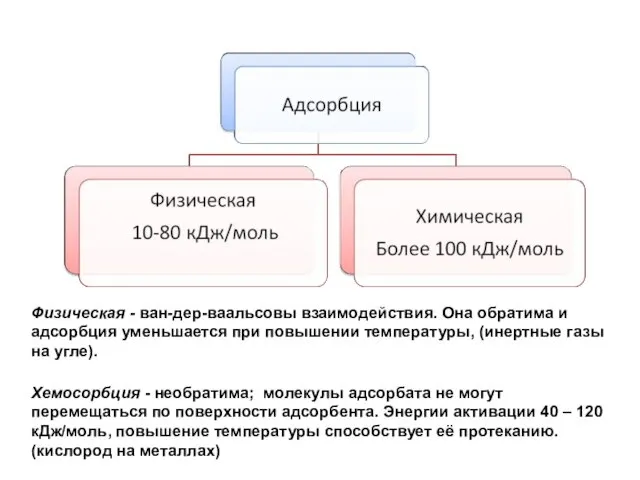
- 8. Сорбция
- 9. Физическая - ван-дер-ваальсовы взаимодействия. Она обратима и адсорбция уменьшается при повышении температуры, (инертные газы на угле).
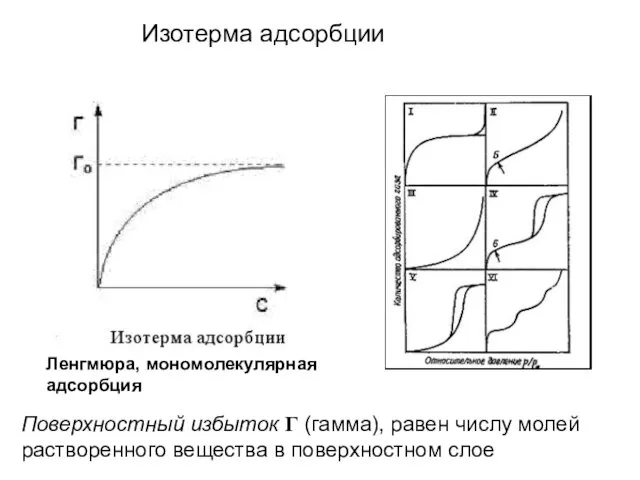
- 10. Изотерма адсорбции Поверхностный избыток Г (гамма), равен числу молей растворенного вещества в поверхностном слое Ленгмюра, мономолекулярная
- 11. Адсорбция из растворов электролитов 1 Адсорбируются преимущественно ионы одного вида. 2.Механизм : обменная и специфическая Обменная
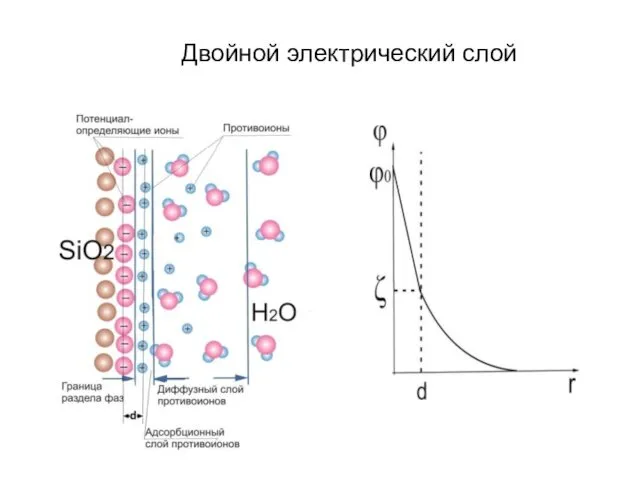
- 12. Двойной электрический слой
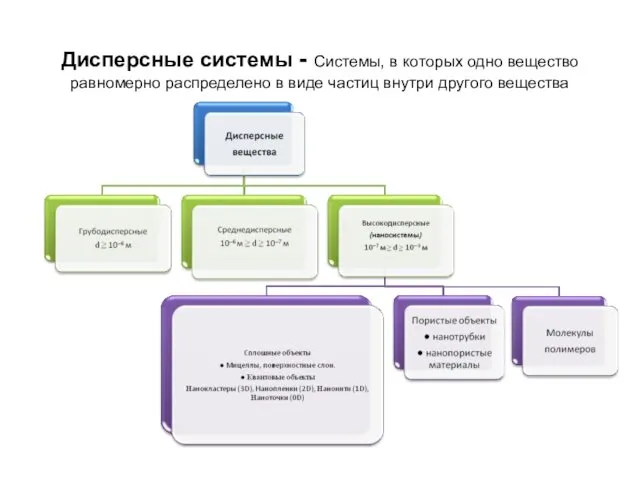
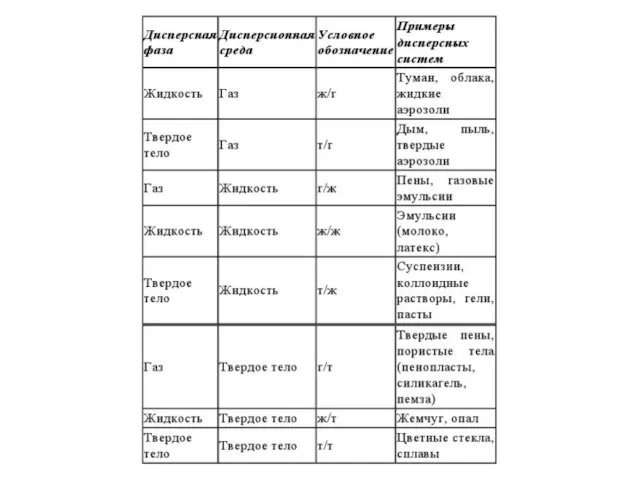
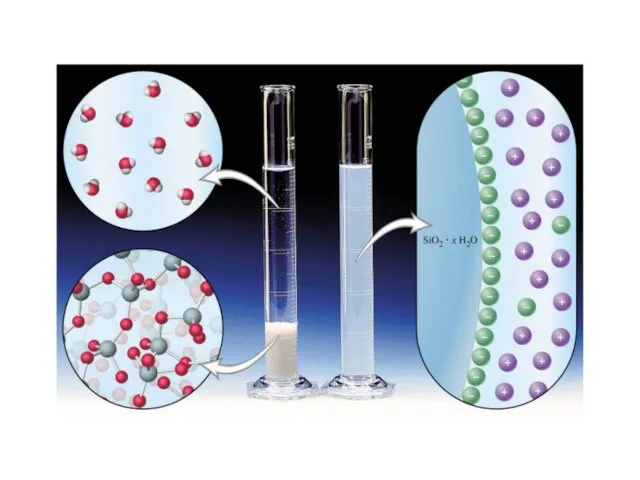
- 13. Дисперсные системы - Системы, в которых одно вещество равномерно распределено в виде частиц внутри другого вещества
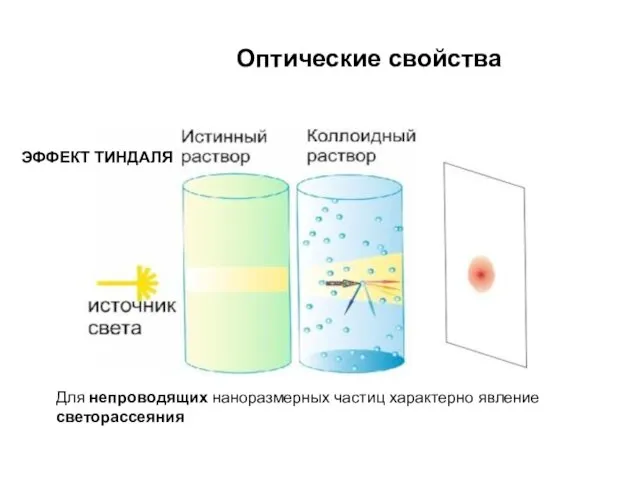
- 15. Оптические свойства Для непроводящих наноразмерных частиц характерно явление светорассеяния ЭФФЕКТ ТИНДАЛЯ
- 16. ЭФФЕКТ ТИНДАЛЯ
- 17. Наночастицы золей металлов в значительной мере поглощают световые волны, превращая часть их энергии в тепло. Длина
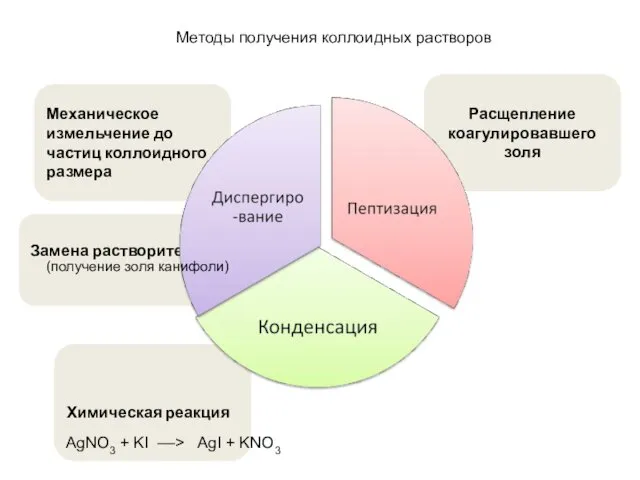
- 18. Замена растворителя Механическое измельчение до частиц коллоидного размера Химическая реакция Расщепление коагулировавшего золя Методы получения коллоидных
- 19. Строение коллоидной мицеллы {[AgI]m · nI– · (n-x)K+}x– · x K+ {[AgI]m · nAg+ · (n-x)NO3–}x+
- 20. nKI+ mAgNO 3 (изб.) = {[AgI]m · nAg+ · (n–x)NO3–}x+ · x NO3– 1)AgI – нерастворимый
- 21. Мицелла золя гидроксида железа {[Fe2O3· 6H2O]m · nFe3+ · 3(n–x)Cl–}3x+ · 3x Cl– , полученного гидролизом
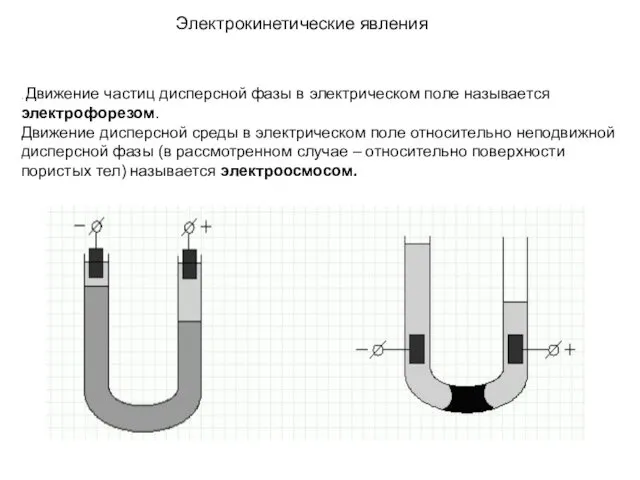
- 23. . Движение частиц дисперсной фазы в электрическом поле называется электрофорезом. Движение дисперсной среды в электрическом поле
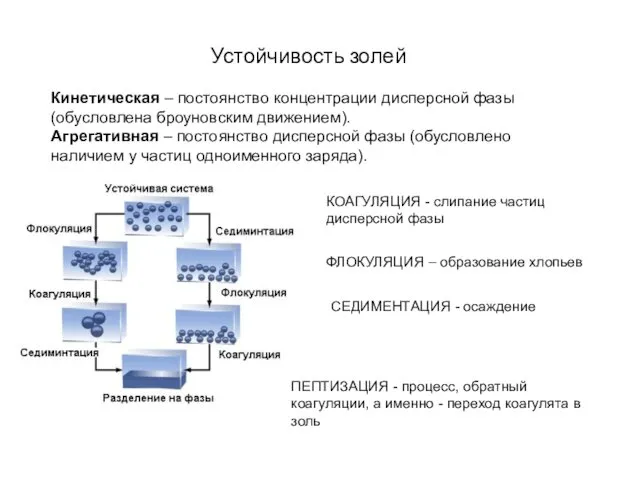
- 24. Кинетическая – постоянство концентрации дисперсной фазы (обусловлена броуновским движением). Агрегативная – постоянство дисперсной фазы (обусловлено наличием
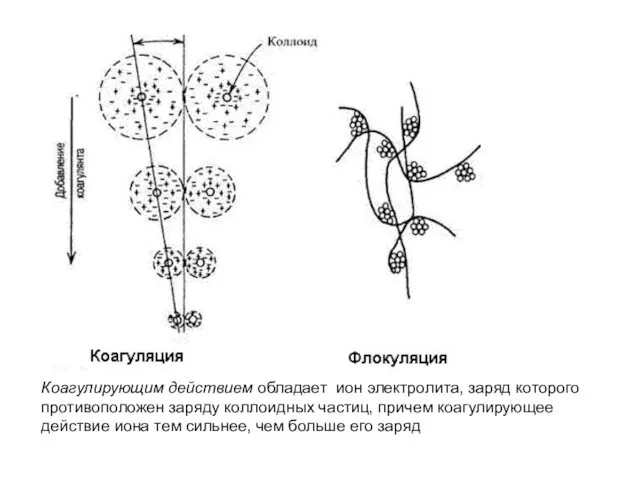
- 25. Коагулирующим действием обладает ион электролита, заряд которого противоположен заряду коллоидных частиц, причем коагулирующее действие иона тем
- 27. Скачать презентацию








![Строение коллоидной мицеллы {[AgI]m · nI– · (n-x)K+}x– · x](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/51285/slide-18.jpg)
![nKI+ mAgNO 3 (изб.) = {[AgI]m · nAg+ · (n–x)NO3–}x+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/51285/slide-19.jpg)
![Мицелла золя гидроксида железа {[Fe2O3· 6H2O]m · nFe3+ · 3(n–x)Cl–}3x+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/51285/slide-20.jpg)
 Жылқының сүт өнімділігі
Жылқының сүт өнімділігі Реформы в 1900 – 1912 гг
Реформы в 1900 – 1912 гг Значение слова пассия
Значение слова пассия Таинство Крещения
Таинство Крещения Эпизоотология лейкоза и туберкулёза в Ордынском районе Новосибирской области
Эпизоотология лейкоза и туберкулёза в Ордынском районе Новосибирской области Техника и технология бурения скважин. Подводные инженерно-технических работы. Плавучие буровые установки и буровые суда
Техника и технология бурения скважин. Подводные инженерно-технических работы. Плавучие буровые установки и буровые суда Реальная математика. Практические расчеты по формулам
Реальная математика. Практические расчеты по формулам Понятие модели. Типы моделей
Понятие модели. Типы моделей Юридическая техника: понятие, виды, способы и приемы
Юридическая техника: понятие, виды, способы и приемы Презентация Огород на подоконнике
Презентация Огород на подоконнике Бюджетная система и бюджетное устройство. Особенности бюджетного процесса в РФ
Бюджетная система и бюджетное устройство. Особенности бюджетного процесса в РФ Использование мультимедийных технологй в целях повышения познавательной деятельности у младших школьников. Дифференциация звуков С-З
Использование мультимедийных технологй в целях повышения познавательной деятельности у младших школьников. Дифференциация звуков С-З Музеи в жизни города. 3 класс
Музеи в жизни города. 3 класс Покажи свое настроение. Обида
Покажи свое настроение. Обида Случайные события и их вероятности
Случайные события и их вероятности Господарство та економічна думка в період державно-монополістичного розвитку суспільств європейської цивілізації
Господарство та економічна думка в період державно-монополістичного розвитку суспільств європейської цивілізації Системы документальной электросвязи
Системы документальной электросвязи Аддитивное производство
Аддитивное производство Дорожные знаки
Дорожные знаки Олимпийское движение. Сочи - 2014 г
Олимпийское движение. Сочи - 2014 г История возникновения театрального искусства в Саратове.
История возникновения театрального искусства в Саратове. Что такое исследовательская работа. Автор : Буркаль Е.В.
Что такое исследовательская работа. Автор : Буркаль Е.В. Технология производства шампанского. Виды шампанских вин
Технология производства шампанского. Виды шампанских вин Культурно-зрелищные здания
Культурно-зрелищные здания Ведомственные строительные нормы. Оценка физического износа жилых зданий
Ведомственные строительные нормы. Оценка физического износа жилых зданий Производство гибких печатных плат без металлизированных отверстий
Производство гибких печатных плат без металлизированных отверстий Для пап и детей. Образ отца в литературе для детей. Часть 2
Для пап и детей. Образ отца в литературе для детей. Часть 2 Презентация Русская матрешка
Презентация Русская матрешка