Слайд 2

Задачи:
Довести до обучающихся цели и задачи урока;
Дать понятие «карбоксильная группа», определение
«карбоновые кислоты»;
Объяснить классификацию карбоновых кислот;
Подготовить обучающихся к составлению формул одноосновных карбоновых кислот, изомеров и их названий по международной номенклатуре;
Организовать самостоятельную работу с учебником при изучении физических свойств, нахождение в природе органических кислотах;
Подвести к выводу как изменяется растворимость кислот с увеличением молекулярных масс;
Проверить усвоение учебного материала обучающимися.
Слайд 3

Никак нельзя обойтись на уроке без лабораторных опытов, поскольку они способствуют
выработке умений и навыков проведения химического эксперимента.
При изучении нового материала учащиеся работали с рабочими тетрадями: записывали формулировки, составляли формулы одноатомных предельных карбоновых кислот, писали название по международной номенклатуре, тривиальные названия, произносили вслух для запоминания; самостоятельно составляли изомеры, называли их по международной номенклатуре, самостоятельно изучали по учебнику нахождение в природе.
Слайд 4

ПЛАН.
1.Организационный момент.
2.Основная часть урок-лекции:
А)Строение функциональной группы и формулы карбоновых кислот.
Б)Гомологический ряд
предельных одноатомных и изомеров,названия.
В)Физические свойства.
Г)Химические свойства.Лабораторные опыты.
Д)Получение и применение.
Слайд 5

КАРБО́НОВЫЕ КИСЛО́ТЫ — КЛАСС ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, МОЛЕКУЛЫ КОТОРЫХ СОДЕРЖАТ ОДНУ ИЛИ НЕСКОЛЬКО
ФУНКЦИОНАЛЬНЫХ КАРБОКСИЛЬНЫХ ГРУПП -COOH.
Слайд 6

КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТ
По числу карбоксильных
групп
непредельные
ароматические
одноосновные
двухосновные
многоосновные
предельные
По типу углеводородного
радикала
Слайд 7

ОБЩАЯ ФОРМУЛА ОДНООСНОВНЫХ КИСЛОТ ПРЕДЕЛЬНОГО РЯДА
СnH2n+1COOН
где n может быть равно нулю.
Слайд 8
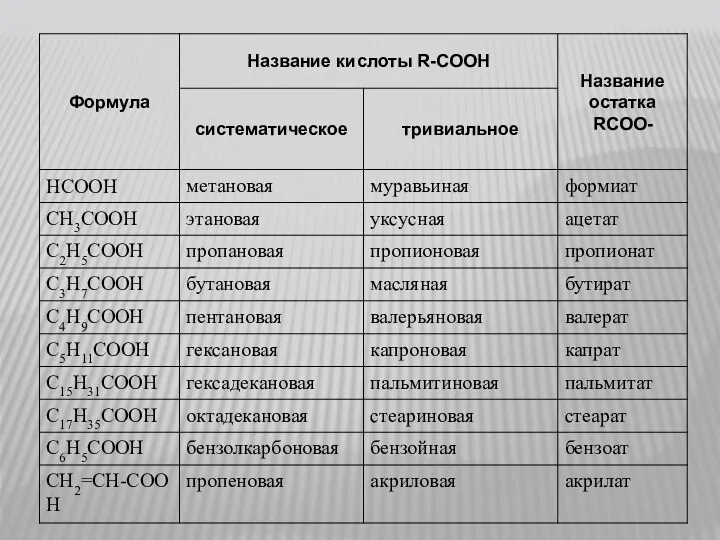
Слайд 9

Изомерия карбоновых кислот.
Cтруктурная изомерия:
изомерия скелета в углеводородном радикале (начиная с C4).
межклассовая изомерия, начиная с C2.
Например, формуле C2H4O2 соответствуют 3 изомера, относящиеся к различным классам органических соединений.
Пространственная изомерия:
Возможна цис-транс изомерия в случае непредельных карбоновых кислот. Например:
Слайд 10

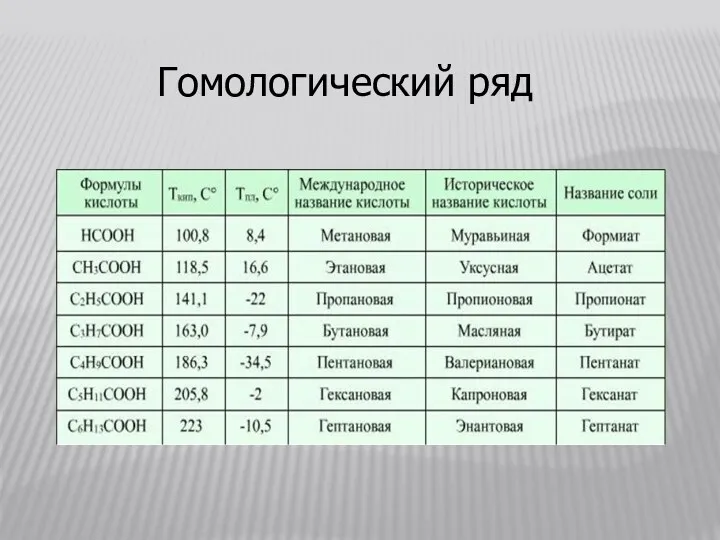
Физические свойства
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в
воде. С повышением относительной молекулярной массы растворимость кислот в воде уменьшается, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
Слайд 11
Слайд 12

Характерные химические реакции
Наиболее важные химические свойства, характерные для большинства карбоновых кислот:
1)
Карбоновые кислоты при реакции с металлами или их осно́вными гидроксидами дают соли соответствующих металлов:
2CH3COOH+Mg-(CH3COO)2Mg+H2
Также карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например:
2CH3COOH+Na2CO3-2CH3COONa+H2CO3
(потом разлагается на углекислый газ и воду). В этих реакциях карбоновые кислоты взаимодействуют также как минеральные кислоты.
2) Карбоновые кислоты в присутствии кислого катализатора 2) Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
CH3COOH + СН3СН2ОН = CH3COOCH2СН3 + H2O
3) При нагревании аммонийных солей карбоновых кислот образуются их амиды.
4) Под действием катализаторов карбоновые кислоты превращаются в соответствующие хлорангидриды.
5)Взаимодействие со щелочами образуется соль и вода:CH3COOH+NaOH-CH3COONa+H2O
6)Карбоновые кислоты взаимодействуют с металлами:
2CH3COOH+CaO-(CH3COO)2Ca+H2O.
Проводим лабораторную работу по взаимодействию карбоновых кислот:
а)с металлами выделяется H2
б)с оксидами металлов ,со щелочами и с солями.
Слайд 13

ДЛЯ КАРБОНОВЫХ КИСЛОТ ХАРАКТЕРНЫ ОСОБЫЕ СВОЙСТВА:
а)2CH3-COOH-CH3-CO-O-OC-CH3+H2O- Образуется ангидрид.
б)Кислоты , вступая в
реакцию с спиртами образует сложные эфиры-CH3COOH + СН3СН2ОН = CH3COOCH2СН3 + H2O
Лабораторный опыт:
Качественная реакция на карбоновые кислоты.
3CH3COOH+FeCL3-(CH3COO)3Fe+3HCL-образовалось кольцо фиолетового цвета.
Применение:
Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла, соли тяжелых металлов – сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот- пищевые добавки, растворители, моно- и диэфиры гликолей и полигликолей пластификаторы, компоненты лаков и алкидных смол, эфиры целлюлозы – компоненты лаков и пластмассы. Амиды кислот эмульгаторы и флотоагены.












 Проект Радио, АО ИД Комсомольская правда. Итоги работы
Проект Радио, АО ИД Комсомольская правда. Итоги работы Система мониторинга и защиты мобильных и стационарных объектов Алмаз. Настройка и монтаж терминальных устройств серии Титан
Система мониторинга и защиты мобильных и стационарных объектов Алмаз. Настройка и монтаж терминальных устройств серии Титан Организация работы классного руководителя и воспитателя в свете национальной инициативы Наша новая школа
Организация работы классного руководителя и воспитателя в свете национальной инициативы Наша новая школа Сейсмические станции и группы
Сейсмические станции и группы Презентация Методы обучения в современной школе
Презентация Методы обучения в современной школе Трубопроводы, агрегаты
Трубопроводы, агрегаты Технология проведения камер по углю и по породе
Технология проведения камер по углю и по породе Анализ финансово-хозяйственной деятельности компании
Анализ финансово-хозяйственной деятельности компании Презентация к уроку: Горные породы и минералы
Презентация к уроку: Горные породы и минералы Теория непоршневого вытеснения нефти водой
Теория непоршневого вытеснения нефти водой Презентация День защиты детей.
Презентация День защиты детей. Презентация Теоретический семинар Подготовка обучающихся к участию в олимпиадах
Презентация Теоретический семинар Подготовка обучающихся к участию в олимпиадах Цветы для мамы. Композиция в технике оригами
Цветы для мамы. Композиция в технике оригами Правила слитных, раздельных и дефисных написаний наречий
Правила слитных, раздельных и дефисных написаний наречий Основы научно-исследовательской работы в школе. Выпускная квалификационная работа
Основы научно-исследовательской работы в школе. Выпускная квалификационная работа Метантенки, характеристика процессов брожения, протекающих в метантенках. Септикотенки
Метантенки, характеристика процессов брожения, протекающих в метантенках. Септикотенки Введение в Arduino
Введение в Arduino Религия. Православие
Религия. Православие Коллаж Волшебный осенний лес.
Коллаж Волшебный осенний лес. Книга памяти д. Мартяхино Тонкинского района Нижегородской области о земляках, погибших на фронтах Великой Отечественной войны
Книга памяти д. Мартяхино Тонкинского района Нижегородской области о земляках, погибших на фронтах Великой Отечественной войны Строевая подготовка. Строевая стойка и повороты на месте. Выход из строя и постановка в строй (занятие №23)
Строевая подготовка. Строевая стойка и повороты на месте. Выход из строя и постановка в строй (занятие №23) Мои любимые друзья. Открытки и стихи
Мои любимые друзья. Открытки и стихи Пословицы и поговорки – народная копилка евангельских нравственных принципов
Пословицы и поговорки – народная копилка евангельских нравственных принципов Геологическое строение территории России
Геологическое строение территории России График функции. Различные способы построения графиков функций
График функции. Различные способы построения графиков функций Духовная жизнь Серебренного века
Духовная жизнь Серебренного века Составное именное сказуемое
Составное именное сказуемое Урок-обобщение по теме Металлы в 9 классе Химический хоккей
Урок-обобщение по теме Металлы в 9 классе Химический хоккей