Метки, используемые в иммуноанализе, способы введения меток в молекулы антител (антигенов) презентация
- Главная
- Без категории
- Метки, используемые в иммуноанализе, способы введения меток в молекулы антител (антигенов)

Содержание
- 2. Метки в иммуноферментном анализе. Основными требованиями к молекулам ферментов для возможности их использования в качестве меток
- 3. Щелочная фосфатаза катализирует гидролиз фосфорных эфиров: 4-нитрофенилфосфат превращается в 4-нитрофенол, регистрируемый по оптической плотности при 405
- 4. В качестве метки в иммуноферментном анализе обычно также используют глюкозооксидазу из Aspergillus niger. Принцип измерения каталитической
- 5. Способы введения ферментативной метки Периодатный метод
- 6. Использование гомобифункциональных сшивающих агентов
- 7. Использование гетеробифункциональных сшивающих агентов
- 8. Введение метки в гаптен
- 10. Из-за разнообразия объектов исследования — от низкомолекулярных соединений до вирусов и бактерий, и многообразия условий проведения
- 11. Примером неконкурентного формата ИФА является «сэндвич»-метод. К носителю с иммобилизованными антителами добавляют раствор, содержащий анализируемый антиген.
- 12. Среди конкурентных схем твердофазного ИФА существует два основных формата: Прямой конкурентный формат ИФА использует иммобилизованые на
- 13. В непрямом конкурентном формате ИФА используются меченные ферментом антитела формате ИФА используются меченные ферментом антитела (специфические
- 14. Основные достоинства ИФА, обеспечившие широкую распространенность метода: высокая чувствительность, позволяющая выявлять концентрации антигена до 10 пг/мл;
- 15. Применение ИФА: диагностика инфекционных заболеваний: обнаружение антигенов возбудителя; обнаружение антител к антигенам возбудителя; мониторинг заболевания, определение
- 16. Гетерогенные методы иммуноферментного анализа Гетерогенный ИФА объединяет методы, в которых анализ проводится в двухфазной системе, при
- 17. Схема твердофазного ИФА для определения антигена
- 18. Первые (захватывающие) антитела сорбируют на стенках лунок. Исследуемый материал вносят в лунку, при этом антиген, взаимодействуя
- 19. При серодиагностике используются полистирольные планшеты, на стенках которых заранее с помощью тех или иных методов адсорбируется
- 20. Схема твердофазного ИФА для определения антител
- 21. Конкурентный твердофазный ИФА низкомолекулярных антигенов может быть реализован по следующей схеме. К иммобилизованным на носителе антителам
- 22. Схема конкурентного твердофазного ИФА для определения антигена
- 23. Метки используемые в радиоиммунологических исследованиях β--распад (n = p + e- νe), β+-распад (p = n
- 24. Существуют следующие четыре основных метода внутреннего маркирования: 1) Бомбардировка соединения нейтронами в атомном реакторе. Обычно к
- 25. Методы йодирования
- 27. Радиоиммунный анализ (РИА) РИА разработан в 50-х годах прошлого века Yalow R.S. и Berson S.A. (определение
- 29. Иммунорадиометрический анализ (ИРМА) Определение антител с помощью изотопной метки получило название иммунорадиометрического анализа. В качестве примера
- 31. Элиспот (ELIspot), ЭС ЭС – метод определения клеток, секретирующих определенные продукты (цитокины, антитела, медиаторы и др.).
- 32. Отличия тИФА и Элиспот
- 33. Иммуноблот ИБ (вестернблот) ИБ – метод, позволяющий одновременно выявлять специфические антитела к спектру антигенов (к каждому
- 35. Иммуногистохимия, иммуноцитохимия (ИГХ) ИГХ – комплекс методов, позволяющих выявлять (визуализировать) определенные антигены в составе естественного клеточного
- 37. Гомогенные методы иммуноферментного анализа К гомогенным относятся методы, осуществляемые в однофазной системе, и не требующие стадии
- 39. Скачать презентацию
Метки в иммуноферментном анализе. Основными требованиями к молекулам ферментов для возможности
Метки в иммуноферментном анализе. Основными требованиями к молекулам ферментов для возможности
Пероксидаза катализирует реакцию
AH2 + H2O2 → A + 2H2O
В качестве AH2 могут быть разные соединения. Так, восстановленный бесцветный о-фенилендиамин в пероксидазной реакции превращается в окисленную окрашенную форму с максимумом оптического поглощения при 435 нм, регистрируемую фотометрически. В качестве субстратов используют: 5-аминосалициловую кислоту, п-оксифенилпропионовую кислоту, окисление иодид ионов
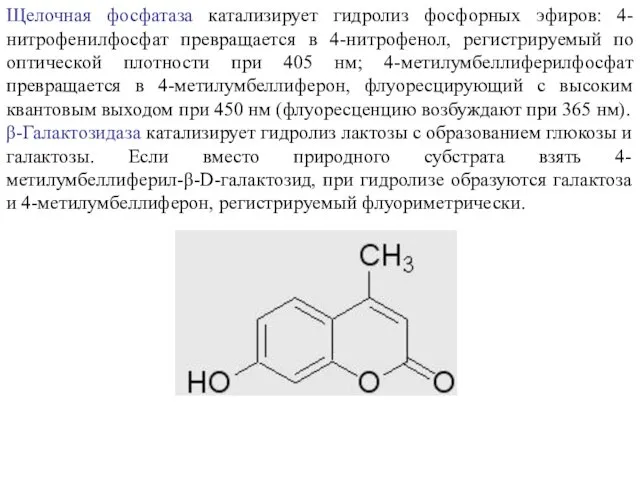
Щелочная фосфатаза катализирует гидролиз фосфорных эфиров: 4-нитрофенилфосфат превращается в 4-нитрофенол, регистрируемый
Щелочная фосфатаза катализирует гидролиз фосфорных эфиров: 4-нитрофенилфосфат превращается в 4-нитрофенол, регистрируемый
β-Галактозидаза катализирует гидролиз лактозы с образованием глюкозы и галактозы. Если вместо природного субстрата взять 4-метилумбеллиферил-β-D-галактозид, при гидролизе образуются галактоза и 4-метилумбеллиферон, регистрируемый флуориметрически.
В качестве метки в иммуноферментном анализе обычно также используют глюкозооксидазу из
В качестве метки в иммуноферментном анализе обычно также используют глюкозооксидазу из
Принцип измерения каталитической активности основан на регистрации продукта реакции — перекиси водорода с помощью пероксидазы хрена.
В иммуноферментном анализе часто используют бактериальную глюкозо-6-фосфатдегидрогеназу из Leuconostos mesenteroides. Фермент не содержит SH-групп и обладает высокой стабильностью.
Фиксируют скорость изменения оптической плотности раствора при длине волны 340 нм.
Малатдегидрогеназа катализирует реакцию восстановления оксалоацетата до малата под действием NADH:
Каталитическую активность измеряют по скорости уменьшения оптической плотности восстановленной формы NADH при длине волны 340 нм.
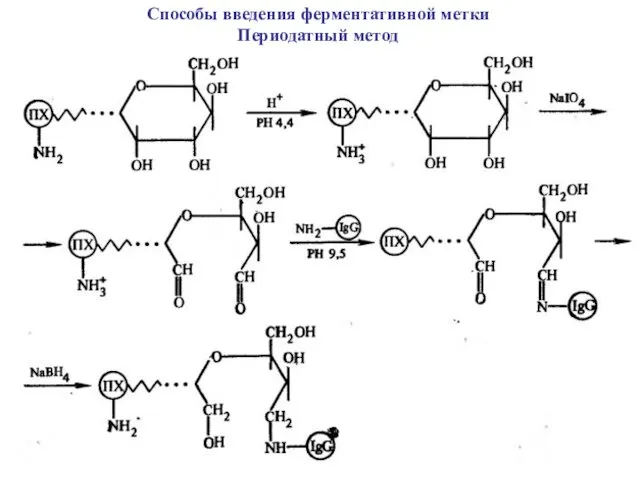
Способы введения ферментативной метки
Периодатный метод
Способы введения ферментативной метки
Периодатный метод
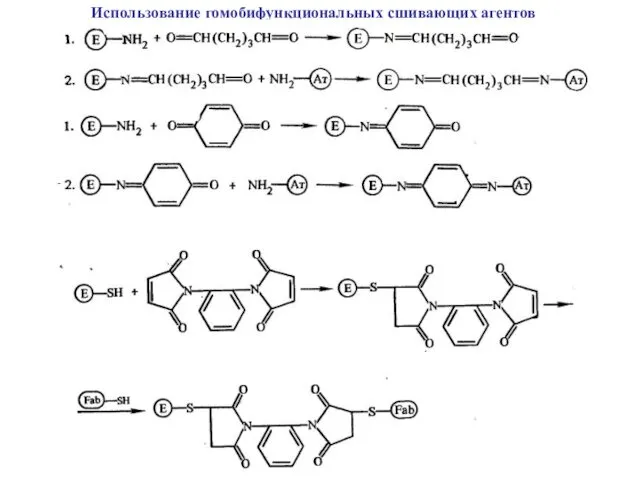
Использование гомобифункциональных сшивающих агентов
Использование гомобифункциональных сшивающих агентов
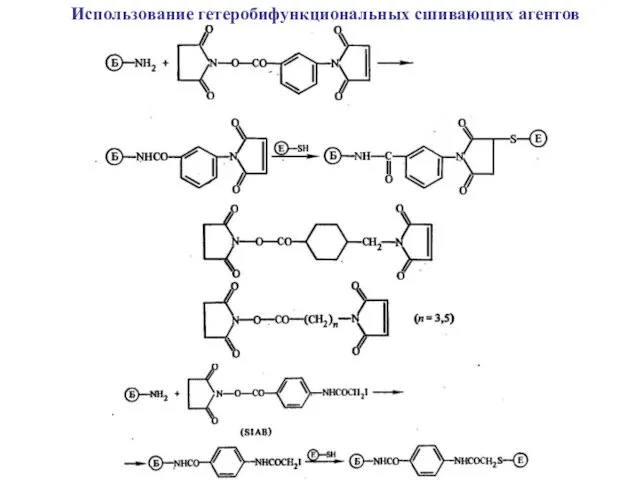
Использование гетеробифункциональных сшивающих агентов
Использование гетеробифункциональных сшивающих агентов
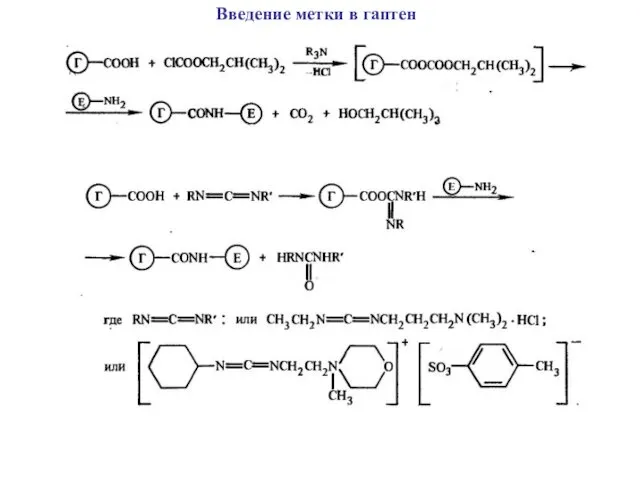
Введение метки в гаптен
Введение метки в гаптен
Из-за разнообразия объектов исследования — от низкомолекулярных соединений до вирусов и бактерий,
Из-за разнообразия объектов исследования — от низкомолекулярных соединений до вирусов и бактерий,
Возможна классификация по типу иммунохимического взаимодействия на первой стадии анализа (в которой происходит связывание определяемого вещества). Если в системе присутствуют только анализируемое соединение и соответствующие ему центры связывания (антиген и специфические антитела), то метод является неконкурентным. Если же на первой стадии в системе одновременно присутствует анализируемое соединение и его аналог (меченное ферментом анализируемое соединение или анализируемое соединение, иммобилизованное на твердой фазе), конкурирующие за ограниченное количество центров специфического связывания, то метод является конкурентным.
Примером неконкурентного формата ИФА является «сэндвич»-метод. К носителю с иммобилизованными антителами добавляют раствор,
Примером неконкурентного формата ИФА является «сэндвич»-метод. К носителю с иммобилизованными антителами добавляют раствор,
Результат оценивается спектрофотометрически или визуально.
«Сэндвич»-метод может быть использован для анализа только тех антигенов, на поверхности которых существуют, по крайней мере, две антигенные детерминанты.
Среди конкурентных схем твердофазного ИФА существует два основных формата:
Прямой конкурентный формат ИФА использует иммобилизованые
Среди конкурентных схем твердофазного ИФА существует два основных формата:
Прямой конкурентный формат ИФА использует иммобилизованые
Преимуществом прямой схемы является небольшое число стадий, что позволяет легко автоматизировать анализ. К недостаткам схемы относятся сложность методов синтеза ферментных конъюгатов, а также возможное влияние компонентов образца на активность фермента.
В непрямом конкурентном формате ИФА используются меченные ферментом антитела формате ИФА используются меченные ферментом антитела (специфические или
В непрямом конкурентном формате ИФА используются меченные ферментом антитела формате ИФА используются меченные ферментом антитела (специфические или
Непрямая схема с использованием меченых антивидовых антител является одной из наиболее распространенных схем ИФА. На поверхности носителя иммобилизуют конъюгат антигенНепрямая схема с использованием меченых антивидовых антител является одной из наиболее распространенных схем ИФА. На поверхности носителя иммобилизуют конъюгат антиген-белок, к которому добавляют раствор, содержащий определяемый антиген и фиксированную концентрацию немеченых специфических антител, инкубируют и после удаления несвязавшихся компонентов добавляют фиксированную концентрацию меченых антивидовых антител. После инкубации и отмывки носителя детектируют ферментативную активность образовавшихся на твердой фазе специфических иммунных комплексов, причем величина сигнала находится в обратно-пропорциональной зависимости от концентрации
определяемого антигена.
Применение универсального реагента — меченых антивидовых антител — даёт возможность выявлять антитела к разным антигенам. Кроме того, анализируемый образец и меченый реагент вводятся в систему на разных стадиях, что устраняет влияние различных эффекторов, содержащихся в образце, на каталитические свойства ферментной метки. Однако такая схема анализа усложняет его проведение из-за введения дополнительных стадий.
Основные достоинства ИФА, обеспечившие широкую распространенность метода:
высокая чувствительность, позволяющая выявлять концентрации
Основные достоинства ИФА, обеспечившие широкую распространенность метода:
высокая чувствительность, позволяющая выявлять концентрации
высокая стандартность и воспроизводимость;
возможность использовать минимальные объемы исследуемого материала;
стабильность при хранении всех ингредиентов, необходимых для проведения ИФА (до года и более);
простота проведения реакции;
наличие как инструментального (в качественном и количественном варианте), так и визуального учета;
возможность автоматизации всех этапов реакции;
относительно низкая стоимость диагностических наборов и оборудования.
Применение ИФА:
диагностика инфекционных заболеваний:
обнаружение антигенов возбудителя;
обнаружение антител к антигенам возбудителя;
мониторинг заболевания,
Применение ИФА:
диагностика инфекционных заболеваний:
обнаружение антигенов возбудителя;
обнаружение антител к антигенам возбудителя;
мониторинг заболевания,
контроль поствакцинального иммунитета;
диагностика аутоиммунных заболеваний:
определение аутоантител;
диагностика аллергических заболеваний:
определение общего и специфического IgE;
определение продуктов активированных эозинофилов, базофилов и тучных клеток;
диагностика злокачественных опухолей:
определение в сыворотке маркеров опухолевого роста;
фенотипирование опухолевых клеток (тканей) для уточнения происхождения и дифференцировки опухоли;
определение концентрации гормонов, параметров менструально-овуляторного цикла;
диагностика беременности;
определение концентрации лекарственных препаратов;
определение допинга;
определение загрязнения окружающей среды;
и многое другое.
Гетерогенные методы иммуноферментного анализа
Гетерогенный ИФА объединяет методы, в которых анализ
Гетерогенные методы иммуноферментного анализа
Гетерогенный ИФА объединяет методы, в которых анализ
Гетерогенный твердофазный ИФА (ELISA = enzyme linked immunosorbent assay) получил наибольшее распространение в медицинской и лабораторной практике. Для его осуществления обычно применяют 96-луночные полистирольные планшеты, так как на полистироле можно легко адсорбировать антитела, а с помощью специальной обработки и различные антигены.
В случае применения ИФА для поиска антигена диагностическую систему строят по принципу «сэндвича» (двухцентровый ИФА). Это означает, что для захвата искомого антигена и его детекции используют различные антитела к разным неинтерферирующим детерминантам.
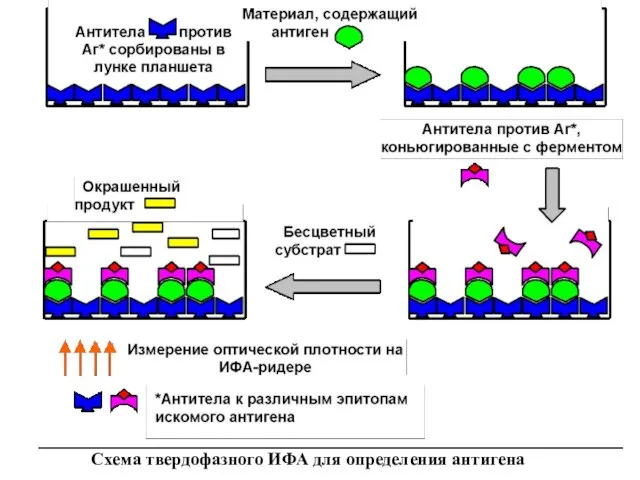
Схема твердофазного ИФА для определения антигена
Схема твердофазного ИФА для определения антигена
Первые (захватывающие) антитела сорбируют на стенках лунок. Исследуемый материал вносят в
Первые (захватывающие) антитела сорбируют на стенках лунок. Исследуемый материал вносят в
Таким образом, изменение окраски содержимого лунки будет свидетельствовать о положительном результате реакции. Более того, интенсивность окрашивания характеризует количество антигена (антител) в образце. Измерение окрашивания раствора обычно проводят на ИФА-ридере (планшетном фотометре).
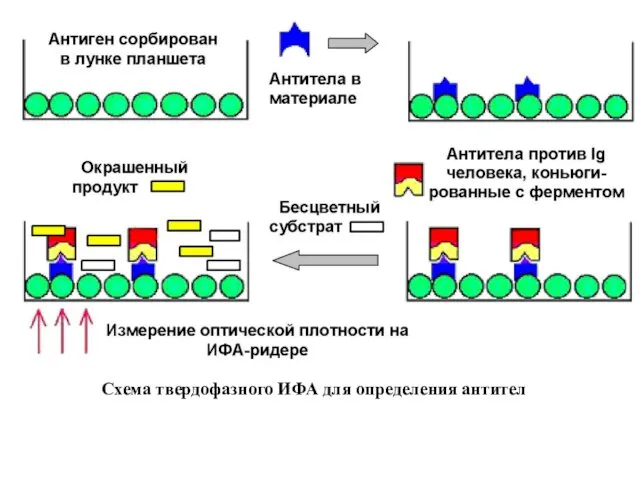
При серодиагностике используются полистирольные планшеты, на стенках которых заранее с помощью
При серодиагностике используются полистирольные планшеты, на стенках которых заранее с помощью
Схема твердофазного ИФА для определения антител
Схема твердофазного ИФА для определения антител
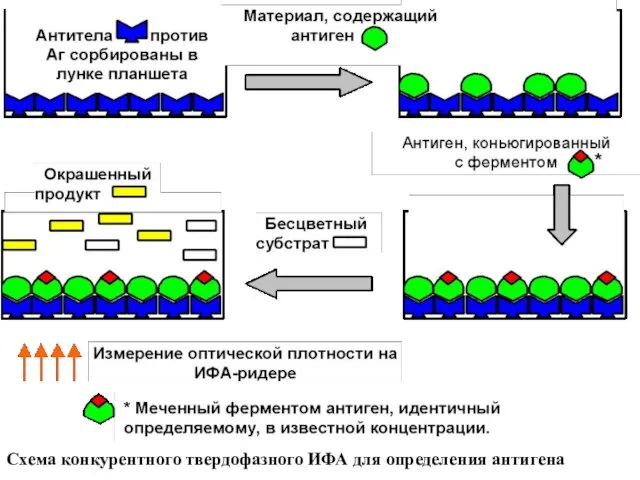
Конкурентный твердофазный ИФА низкомолекулярных антигенов может быть реализован по следующей схеме.
Конкурентный твердофазный ИФА низкомолекулярных антигенов может быть реализован по следующей схеме.
Схема конкурентного твердофазного ИФА для определения антигена
Схема конкурентного твердофазного ИФА для определения антигена
Метки используемые в радиоиммунологических исследованиях
β--распад (n = p + e- νe),
Метки используемые в радиоиммунологических исследованиях
β--распад (n = p + e- νe),
β+-распад (p = n + e+ + νe),
e-захват (p + e- = n + νe),
Существуют следующие четыре основных метода внутреннего маркирования:
1) Бомбардировка соединения нейтронами в атомном
Существуют следующие четыре основных метода внутреннего маркирования:
1) Бомбардировка соединения нейтронами в атомном
2) Химический синтез. Молекулу синтезируют из более простых молекул или элементов, из которых один или несколько находятся в форме радиоактивного изотопа. Такой подход применяется в случае небольших пептидных гормонов; примером может служить синтез вазопрессина из составляющих его аминокислот с применением 3Н-тирозина.
3) Биологический синтез. Молекула синтезируется в биологической системе in vivo или in vitro из радиоактивных предшественников; в качестве примера можно привести синтез простагландина из меченной тритием арахидоновой кис- лоты.
4) Реакции изотопного обмена. Среди методов этого типа наиболее известен метод Вилцбаха, который состоит в том, что вещество, предназначенное для маркировки, распределяют по стенкам сосуда и выдерживают в атмосфере газообразного трития (3Н) при комнатной температуре в течение недели.
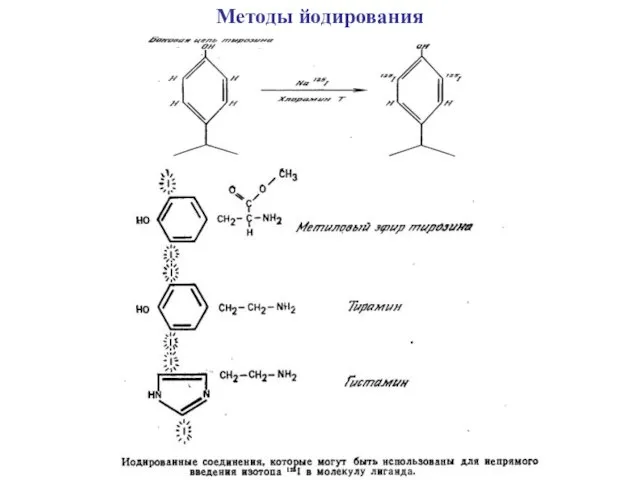
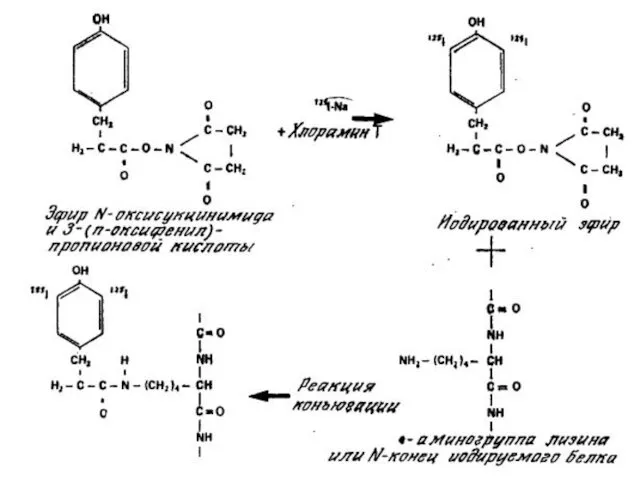
Методы йодирования
Методы йодирования
Радиоиммунный анализ (РИА)
РИА разработан в 50-х годах прошлого века Yalow R.S.
Радиоиммунный анализ (РИА)
РИА разработан в 50-х годах прошлого века Yalow R.S.
Таким образом, РИА является конкурентным гетерогенным методом исследования. Основными преимуществами РИА является высокая чувствительность и специфичность. Применение изотопной метки и мечение антигена обеспечивают высокий уровень соотношения сигнал/шум и низкое неспецифическое связывание метки.
Разработан также твердофазный РИА (разделение связавшихся и свободных антигенов достигается простой промывкой флаконов/планшет).
Иммунорадиометрический анализ (ИРМА)
Определение антител с помощью изотопной метки получило название иммунорадиометрического
Иммунорадиометрический анализ (ИРМА)
Определение антител с помощью изотопной метки получило название иммунорадиометрического
РАСТ был разработан в начале 1970-х (Wide L.) для определения аллерген-специфических IgE в сыворотке крови. Аллерген сорбировали на пористом носителе (бумага, полимерные мембраны, гранулы, губки). Далее добавляли сыворотку пациента, инкубировали 3 часа, отмывали и добавляли антиглобулиновую сыворотку (против IgE), меченную радиоактивным изотопом. После отмывки несвязавшихся реагентов, радиоактивность учитывали на счетчике.
Элиспот (ELIspot), ЭС
ЭС – метод определения клеток, секретирующих определенные продукты (цитокины,
Элиспот (ELIspot), ЭС
ЭС – метод определения клеток, секретирующих определенные продукты (цитокины,
ЭС применяется для определения секреции цитокинов, антител, биоактивных веществ и медиаторов с целью определения функционального состояния иммунных клеток (цитокиновый профиль, поляризация иммунного ответа Th1-Th2-Th3, функция клеток-регуляторов), секреции специфических и общих IgE и др. для диагностики, мониторинга и контроля терапии аллергии, аутоиммунных заболеваний, трансплантационного иммунного ответа, противоопухолевого иммунитета и т.д.
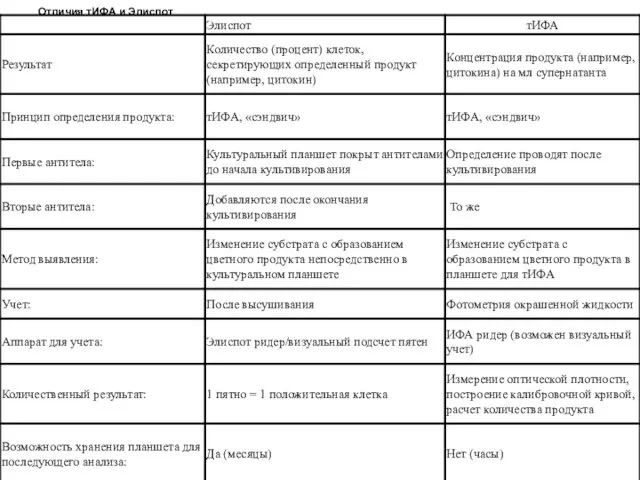
Отличия тИФА и Элиспот
Отличия тИФА и Элиспот
Иммуноблот ИБ (вестернблот)
ИБ – метод, позволяющий одновременно выявлять специфические антитела к
Иммуноблот ИБ (вестернблот)
ИБ – метод, позволяющий одновременно выявлять специфические антитела к
Этапы постановки ИБ :
1. Подготовка антигенов: лизис/дезинтеграция вирусов, бактерий;
обработка додецил сульфатом натрия (SDS) для придания всем компонентам схожего соотношения отрицательный заряд/молекулярная масса.
2. Получение блотов: разгонка антигенов в электрофорезе (пропорционально размеру);
перенос антигенов на мембрану;
разрезание мембраны на блоты (полоски, содержащие спектр антигенов) .
3. Проведение реакции: обработка блота сывороткой больного (специфические антитела больного связываются с соответствующими антигенами);
выявление связавшихся антител антивидовыми антителами к иммуноглобулинам человека, меченными ферментом;
внесение субстрата и проявление блотов (при связывании специфических антител в месте связывания образуется пятно);
учет реакции (сравнение результата с положительным и отрицательным контролями) и выдача заключения.
ИБ применяют для: подтверждения результатов других серологических реакций;
идентификации бактериальных или вирусных белков;
идентификации микробов;
научных целей.
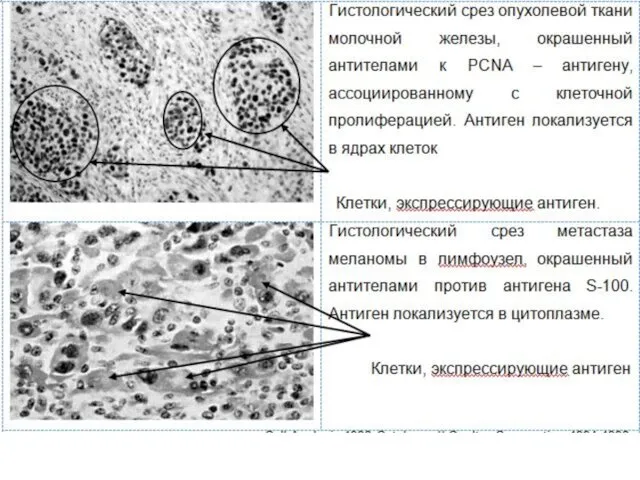
Иммуногистохимия, иммуноцитохимия (ИГХ)
ИГХ – комплекс методов, позволяющих выявлять (визуализировать) определенные антигены
Иммуногистохимия, иммуноцитохимия (ИГХ)
ИГХ – комплекс методов, позволяющих выявлять (визуализировать) определенные антигены
Постановка ИГХ предусматривает следующие этапы:
забор материала;
приготовление гистологических (цитологических) препаратов;
фиксацию, подготовку антигенов (зависит от природы антигена и антител);
собственно окрашивание (тИФА: прямой, непрямой, непрямой с усилением сигнала);
учет: микроскопия, фотографирование, выдача заключения.
ИГХ позволяет существенно улучшить специфичность и чувствительность патоморфологического метода исследования, что весьма актуально для диагностики опухолей (метастазов), их тканевого происхождения, степени дифференцировки и т.д.
Гомогенные методы иммуноферментного анализа
К гомогенным относятся методы, осуществляемые в однофазной
Гомогенные методы иммуноферментного анализа
К гомогенным относятся методы, осуществляемые в однофазной
Одним из распространенных методов является EMIT-анализ (enzyme monitored immunoassay technique), основанный на изменении активности ферментной метки в конъюгате фермент-антиген при образовании комплекса с антителами. Обычно взаимодействие приводит к снижению активности вследствие конформационных перестроек в молекуле фермента или стерическом исключении доступа молекулы субстрата к активному центру фермента. Достоинствами гомогенных методов является значительное сокращение времени проведения анализа (несколько минут), недостатками – меньшая чувствительность и возможность влияния состава анализируемого образца на результаты анализа.
























 Виды грунтовок
Виды грунтовок Этиология кариеса зубов
Этиология кариеса зубов Понятие личность
Понятие личность Русские народные музыкальные инструменты
Русские народные музыкальные инструменты Ремонт парка пресс-форм. Литьё пластиковых изделий
Ремонт парка пресс-форм. Литьё пластиковых изделий Работа с бумагой в нетрадиционной технике - квиллинг Букет нарциссов к 8 марта
Работа с бумагой в нетрадиционной технике - квиллинг Букет нарциссов к 8 марта Дифференциальная диагностика опухолей и опухолеподобных процессов костей у детей
Дифференциальная диагностика опухолей и опухолеподобных процессов костей у детей Основы научно-технического творчества. Требования к выполнению расчетно-графической работы, докладов, конспектов
Основы научно-технического творчества. Требования к выполнению расчетно-графической работы, докладов, конспектов Производство гц-проката в цехах северного и южного блоков ПМП ПАО ММК
Производство гц-проката в цехах северного и южного блоков ПМП ПАО ММК презентация Причины травматизма Диск
презентация Причины травматизма Диск презентация к родительскому собранию о портфолио
презентация к родительскому собранию о портфолио проект Солнышко в технике изонити
проект Солнышко в технике изонити Организация научного исследования
Организация научного исследования Принципы работы компьютера. Основные устройства компьютера
Принципы работы компьютера. Основные устройства компьютера Vincent van Gogh (1853-1890)
Vincent van Gogh (1853-1890) История возникновения театрального искусства в Саратове.
История возникновения театрального искусства в Саратове. Present Simple настоящее простое время
Present Simple настоящее простое время What is and when was modernity. Lecture 1. Modernity and Modernism
What is and when was modernity. Lecture 1. Modernity and Modernism Lecture Classification of expressive means and stylistic devices by Y.M.Skrebnev
Lecture Classification of expressive means and stylistic devices by Y.M.Skrebnev Франция. Экономическое развитие Франции. Политическое развитие Франции
Франция. Экономическое развитие Франции. Политическое развитие Франции Социальное взаимодействие. Социальные движения и изменения
Социальное взаимодействие. Социальные движения и изменения Эссе учителя начальных классов МБОУ НОШ с.Хову-Аксы Оюн Вероники Александровны
Эссе учителя начальных классов МБОУ НОШ с.Хову-Аксы Оюн Вероники Александровны Нейрореабилитация
Нейрореабилитация Ерте жастағы эпилептикалық синдромдар
Ерте жастағы эпилептикалық синдромдар Иван Иванович Шишкин
Иван Иванович Шишкин Потребность как главная дефиниция маркетинга
Потребность как главная дефиниция маркетинга Я в социуме - Токаев Сослан
Я в социуме - Токаев Сослан Теплоизоляционные материалы
Теплоизоляционные материалы