Содержание
- 2. Постулаты Бора — основные допущения, сформулированные Нильсом Бором в 1913 году для объяснения закономерности линейчатого спектра
- 3. I ПОСТУЛАТ - ПОСТУЛАТ СТАЦИОНАРНЫХ СОСТОЯНИЙ: В атоме существуют стационарные квантовые состояния, не изменяющиеся с течением
- 4. II ПОСТУЛАТ - ПОСТУЛАТ КВАНТОВАНИЯ МОМЕНТА ДВИЖЕНИЯ ЭЛЕКТРОНА НА ОРБИТЕ В стационарном состоянии атома электрон, двигаясь
- 5. III ПОСТУЛАТ - ПРАВИЛО ЧАСТОТ: При переходе атома из одного стационарного состояния в другое излучается или
- 6. б) Атом поглощает 1 фотон, когда переходит из стационарного состояния с меньшей энергией (E n) в
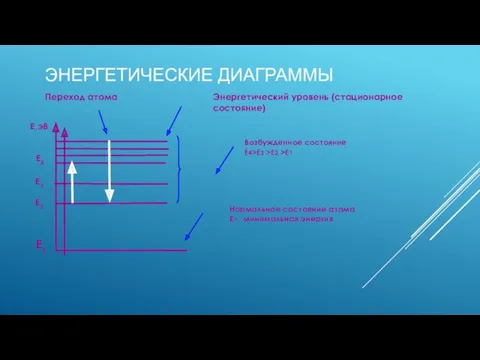
- 7. ЭНЕРГЕТИЧЕСКИЕ ДИАГРАММЫ Возбужденное состояние Е4>Е3 >Е2 >Е1 Переход атома Энергетический уровень (стационарное состояние) Нормальное состояние атома
- 8. МОДЕЛЬ АТОМА ВОДОРОДА ПО БОРУ Свои постулаты Н. Бор применил для построения теории строения простейшего атома
- 9. Модель атома водорода по Бору
- 10. СЕРИИ ИЗЛУЧЕНИЯ АТОМА ВОДОРОДА
- 12. ДЕМОНСТРАЦИЯ ДИАГРАММЫ ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ АТОМА НЕКОТОРЫХ ЭЛЕМЕНТОВ
- 13. РАСПРЕДЕЛЕНИЕ ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ ПРИ ИЗЛУЧЕНИИ (ИСПУСКАНИИ) И ПОГЛОЩЕНИИ АТОМОМ ВОДОРОДА ЭЛЕКТРОМАГНИТНЫХ ВОЛН: При (n = 1)
- 14. ПРИМЕНЕНИЕ ТЕОРИИ БОРА И ЕЁ ЭКСПЕРИМЕНТАЛЬНЫЕ ОБОСНОВАНИЯ Объясняет строение атома водорода и водородоподобных атомов Существование спектральных
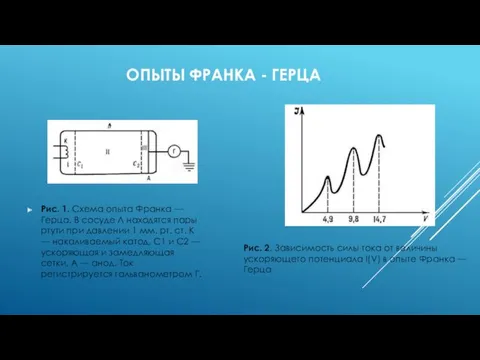
- 15. ОПЫТЫ ФРАНКА - ГЕРЦА Рис. 1. Схема опыта Франка — Герца. В сосуде Л находятся пары
- 16. НЕДОСТАТКИ ТЕОРИИ БОРА Является половинчатой (были использованы законы классической механики и квантовые постулаты) Постулаты Бора являются
- 18. Скачать презентацию













 Процесс создания картины. Натюрморт
Процесс создания картины. Натюрморт Деепричастие. Виды деепричастий
Деепричастие. Виды деепричастий Основы робототехники
Основы робототехники Натюрморт. Композиционное равновесие. Передача пространства
Натюрморт. Композиционное равновесие. Передача пространства Преобразование информации путем рассуждений
Преобразование информации путем рассуждений Особенности учета дров. Правила укладки и обмера, единицы учета, полнодревесность поленниц
Особенности учета дров. Правила укладки и обмера, единицы учета, полнодревесность поленниц Великие люди
Великие люди Сковорода гриль-газ
Сковорода гриль-газ История мыловарения.
История мыловарения. Остеохондроз позвоночника. Грыжа диска
Остеохондроз позвоночника. Грыжа диска История развития вычислительной техники
История развития вычислительной техники Спортивная игра Большие гонки
Спортивная игра Большие гонки Героическая профессия - испытатель
Героическая профессия - испытатель Жалпы гигиена және экология Бөлменің радиациялық фоны.Радон мен оның өнімдерінің гигиеналық маңызы
Жалпы гигиена және экология Бөлменің радиациялық фоны.Радон мен оның өнімдерінің гигиеналық маңызы Презентация к уроку геометрии в 8 классе на тему Взаимное расположение прямой и окружности
Презентация к уроку геометрии в 8 классе на тему Взаимное расположение прямой и окружности Структура и текстура горных пород
Структура и текстура горных пород Генные препараты
Генные препараты Общие сведения о производстве сборных железобетонных изделий
Общие сведения о производстве сборных железобетонных изделий Нематериальные блага как объекты гражданских прав
Нематериальные блага как объекты гражданских прав Интерполирование и численное дифференцирование функций
Интерполирование и численное дифференцирование функций Проведение динамометрирования
Проведение динамометрирования Методическая разработка мастер-класса ИЗОНИТЬ
Методическая разработка мастер-класса ИЗОНИТЬ Русский язык на 4 февраля
Русский язык на 4 февраля Приобщение родителей и детей к здоровому образу жизни в совместной деятельности
Приобщение родителей и детей к здоровому образу жизни в совместной деятельности Российский рынок страхования. Динамика и тенденции
Российский рынок страхования. Динамика и тенденции Организация строительства экспозиционно-выставочного павильона Прорыв в Кировском районе Ленинградской области
Организация строительства экспозиционно-выставочного павильона Прорыв в Кировском районе Ленинградской области Транспорт Архангельской области и его воздействие на окружающую среду
Транспорт Архангельской области и его воздействие на окружающую среду Рынок труда
Рынок труда