Содержание
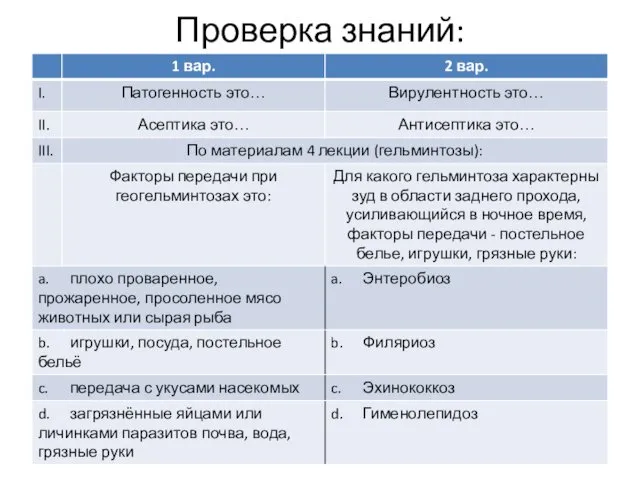
- 2. Проверка знаний:
- 3. Физиология и биохимия микроорганизмов (6 лекция)
- 4. Физиология микроорганизмов 1.Классификация микроорганизмов по физиологическим особенностям 2.Понятие о чистой культуре, штамме 3.Бактериологический метод 4.Классификация питательных
- 5. Метаболизм В биохимическом отношении все живые существа на Земле сходны (принцип биохимического единства А.Клюйвера) – вся
- 6. На 80-90% клетка бактерии состоит из воды, остальное – сухое вещество, из которого 52% - белки,
- 7. Автотрофы – могут синтезировать органические соединения из неорганических (из CO2 и воды), используя дополнительные источники энергии.
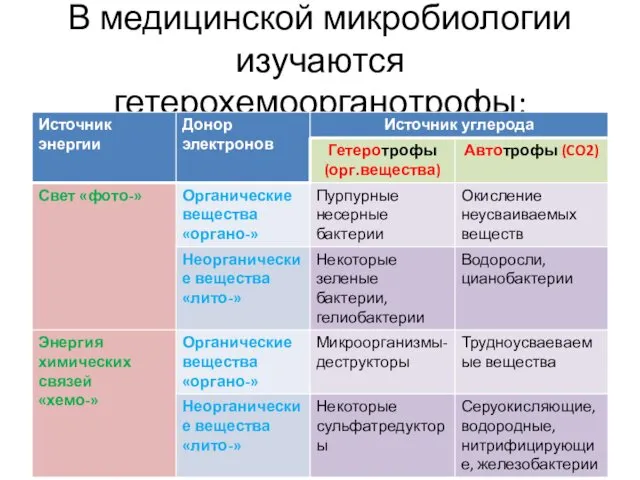
- 8. В медицинской микробиологии изучаются гетерохемоорганотрофы:
- 9. Классификация бактерий по способу питания (пояснения к таблице) 1. По источнику углерода Аутотрофы используют углерод неорганических
- 10. Сапрофиты – питаются мёртвым органическим материалом. Паразиты – зависят в получении питательных веществ от макроорганизма. Среди
- 11. Получение энергии бактериями: При окислительно-восстановительном процессе электроны переносятся от донора к акцептору. При этом выделяется энергия,
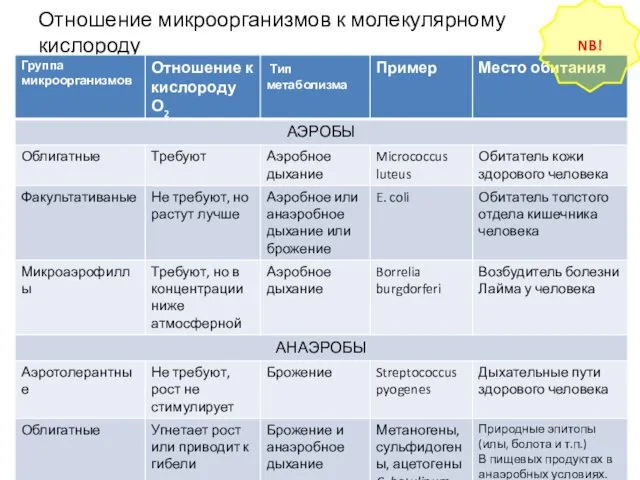
- 12. В зависимости от характера дыхания/отношения к О2 проводится классификация бактерий по типу дыхания: Облигатные (строгие) аэробы:
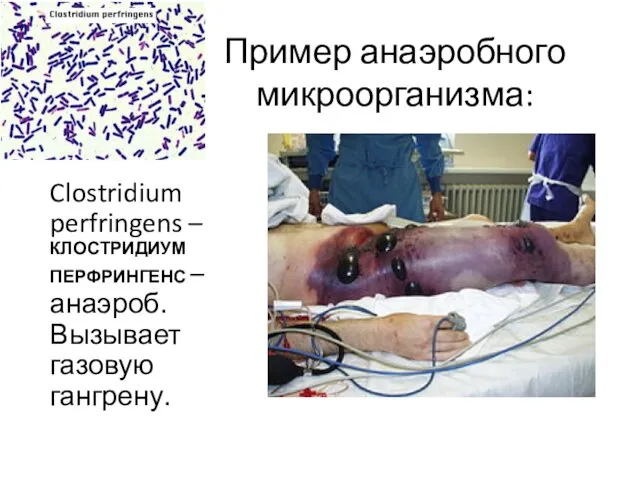
- 13. Пример анаэробного микроорганизма: Clostridium perfringens – КЛОСТРИДИУМ ПЕРФРИНГЕНС – анаэроб. Вызывает газовую гангрену.
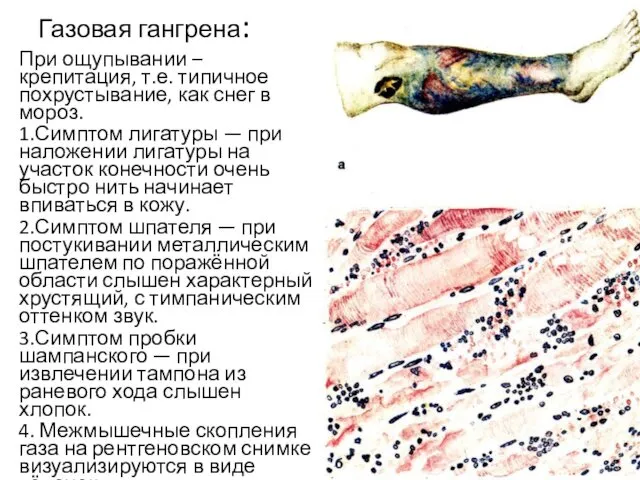
- 14. Газовая гангрена: При ощупывании – крепитация, т.е. типичное похрустывание, как снег в мороз. 1.Симптом лигатуры —
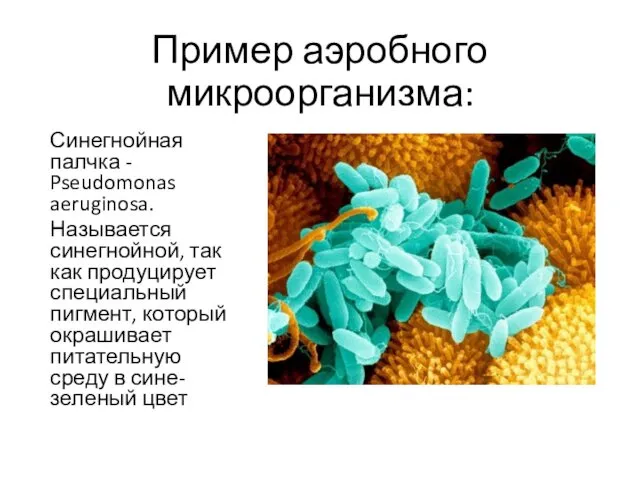
- 15. Пример аэробного микроорганизма: Синегнойная палчка - Pseudomonas aeruginosa. Называется синегнойной, так как продуцирует специальный пигмент, который
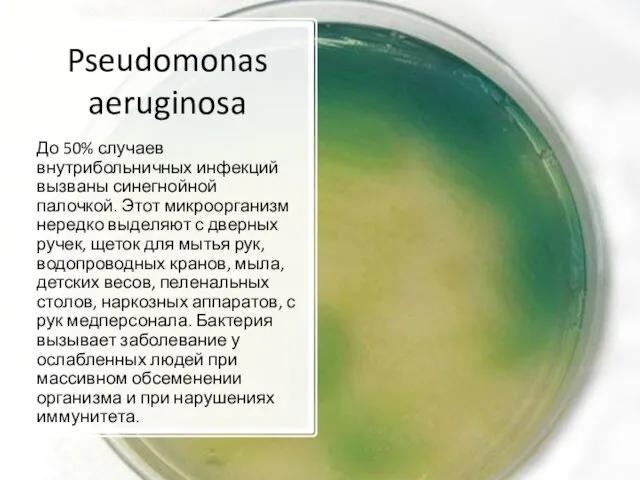
- 16. Pseudomonas aeruginosa До 50% случаев внутрибольничных инфекций вызваны синегнойной палочкой. Этот микроорганизм нередко выделяют с дверных
- 17. Отношение микроорганизмов к молекулярному кислороду NB!
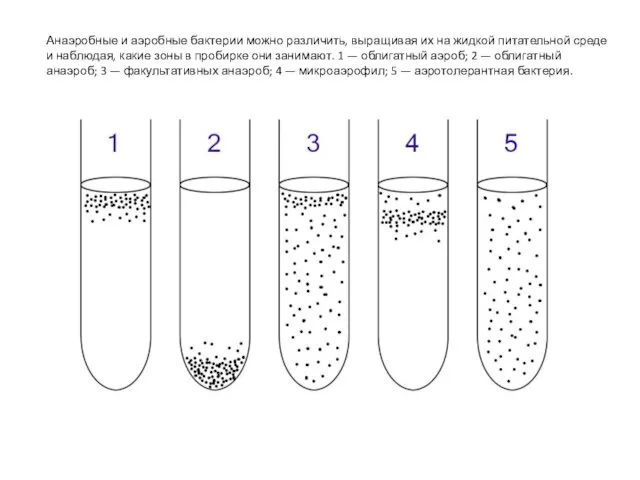
- 18. Анаэробные и аэробные бактерии можно различить, выращивая их на жидкой питательной среде и наблюдая, какие зоны
- 19. Брожение или ферментация: процесс получения энергии, при котором как донором, так и акцептором электронов служат органические
- 20. Питательные среды: история
- 21. В 1883 году Р. Кох разработал метод выделения чистых культур микробов путем посева на пластинки желатина.
- 22. Питательные среды для выращивания бактерий Источниками биогенов, других элементов, ростовых и питательных веществ служат : Мясо
- 23. Приготовление питательной смеси в лаборатории:
- 24. Среды: по составу: натуральные (см.выше – имеют неопределенный химический состав), полусинтетические и синтетические(содержат только химически чистые
- 25. Агар-агар Пищевая добавка E406
- 26. Питательные среды предназначены для накопления, выделения и изучения, а также сохранения микроорганизмов. Для обеспечения различных типов
- 27. Виды специальных сред Элективные (избирательные) – содержат компоненты положительной (оптимальные условия для нужного МО) или отрицательной
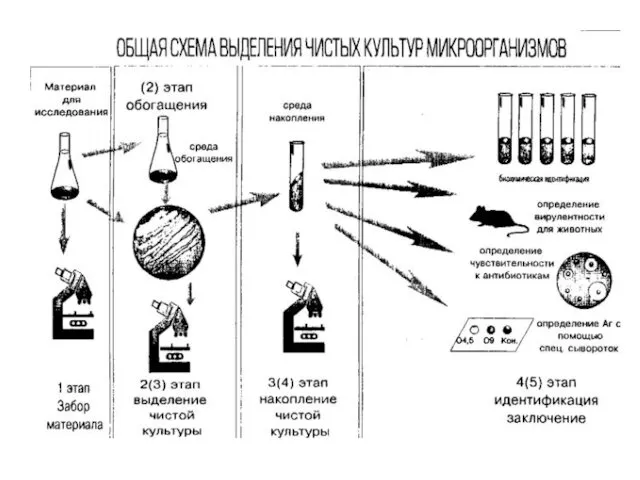
- 28. Культивирование микроорганизмов в лабораторных условиях 1 этап выделения чистых культур: Микроскопия (ориентировочная) Подготовка материала к исследованию
- 30. Выделение и идентификация чистых культур 2 этап (изолированные колонии) Макроскопическое изучение колоний в проходящем свете (величина,
- 31. Выделение и идентификация чистых культур 3 этап (чистая культура) Идентификация выделенной культуры по комплексу биологических свойств:
- 32. Иногда при необходимости разделения микроорганизмов к среде культивирования добавляют компоненты, избирательно подавляющие рост тех или иных
- 33. Выделение чистых культур микроорганизмов. При бактериологическом исследовании искомый микроорганизм обнаруживают в материале, как правило, в смеси
- 34. Метод Дригальского: берут три-пять чашек Петри с плотной питательной средой. В одну из чашек вносят посевной
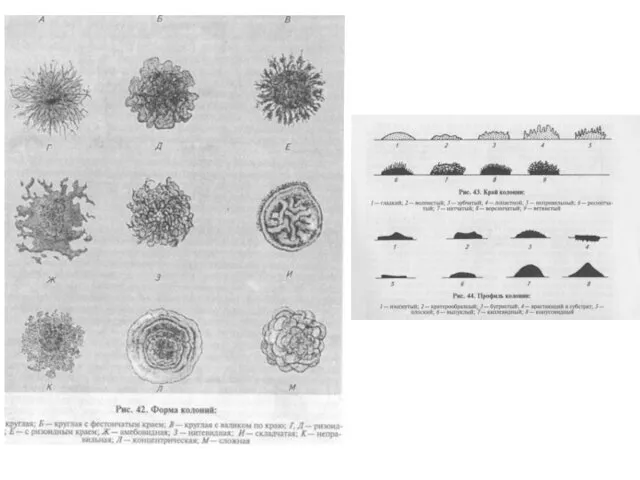
- 35. Изучение изолированных колоний и отвивка (пересев) чистых культур МО Колония — макроскопически видимое скопление клеток микроорганизма
- 37. Биохимическая идентификация бактерий Способность бактерий расщеплять белки (протеолитические ферменты МО) – на средах с желатином (разжижжение
- 38. Ферменты бактерий Ферменты – биологические катализаторы, ускоряющие течение метаболических реакций. Эндоферменты - работают внутри бактериальной клетки,
- 39. Отличия по набору ферментов: Микроорганизмы синтезируют разнообразные ферменты, принадлежащие к шести различным классам, что определяется геномом
- 40. Определение ферментного спектра микроорганизмов как этап идентификации. В пределах семейства у представителей разных родов можно обнаружить
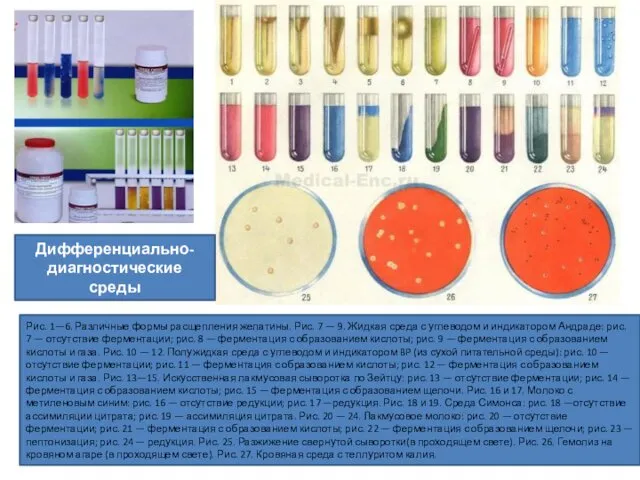
- 41. Выявление сахаролитической активности микроорганизмов. В состав дифференциально-диагностических углеводных сред (среды Гисса — см. выше) входят различные
- 42. Индикатор Андрэдэ (кислый фуксин —0,5 г, 1%-й раствор гидроксида натрия — 16 мл, дистиллированная вода —
- 43. Рис. 1—6. Различные формы расщепления желатины. Рис. 7 — 9. Жидкая среда с углеводом и индикатором
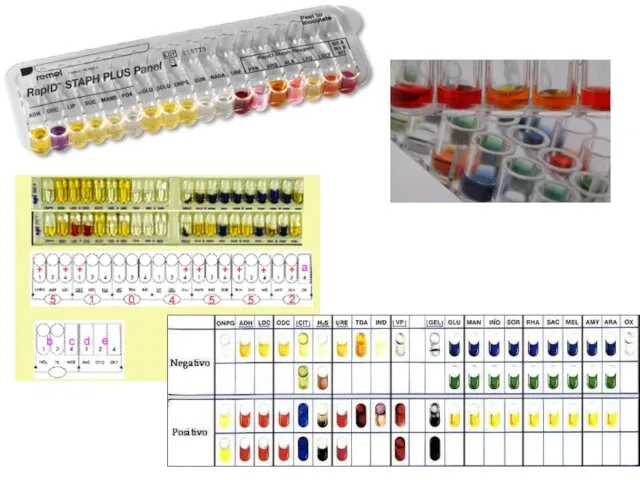
- 44. Тест-системы для быстрой идентификации бактерий Тест-системы для быстрой идентификации бактерий по группе специально отобранных биохимических признаков
- 46. Глоссарий: Внести в глоссарий варианты отношения микроорганизмов к кислороду (5 видов). Внести в глоссарий классификацию питательных
- 47. РЕБУС 1. Загуститель, высокомолекулярный полисахарид, который содержится в некоторых морских водорослях. 2. Направленное движение бактерий 3.
- 49. Скачать презентацию


































 Инклюзивное обучение детей с РАС
Инклюзивное обучение детей с РАС Сварочный термический цикл. Напряжения и деформации при сварке
Сварочный термический цикл. Напряжения и деформации при сварке Приёмы устного умножения и деления трёхзначных чисел
Приёмы устного умножения и деления трёхзначных чисел Политика и власть
Политика и власть Презентация Изготовление кормушки
Презентация Изготовление кормушки Информационно-коммуникативные технологии как средство формирования проектно-исследовательских компетенций обучающихся
Информационно-коммуникативные технологии как средство формирования проектно-исследовательских компетенций обучающихся Великая Отечественная война
Великая Отечественная война Программа для проведения шифрования и дешифрования текста при помощи ключа
Программа для проведения шифрования и дешифрования текста при помощи ключа Токарно-револьверный станок 1Г340П
Токарно-револьверный станок 1Г340П prezentatsiya-poklon-zemle-surovoj-i-prekrasnoj
prezentatsiya-poklon-zemle-surovoj-i-prekrasnoj Портфолио. Соковикова Татьяна
Портфолио. Соковикова Татьяна Аварии с выбросом аварийно химически опасных веществ
Аварии с выбросом аварийно химически опасных веществ Презентация Всё гениальное, очень интересно!
Презентация Всё гениальное, очень интересно! Ынтымағы жарасқан, туған өлкем - Қазақстан
Ынтымағы жарасқан, туған өлкем - Қазақстан Тотемизм. Примеры тотемизма
Тотемизм. Примеры тотемизма Наполеон Бонапарт
Наполеон Бонапарт Движение по регулируемому пешеходному переходу
Движение по регулируемому пешеходному переходу Отчёт о производственно-хозяйственной деятельности за 2017 год филиала завода по подготовке конденсата к транспорту
Отчёт о производственно-хозяйственной деятельности за 2017 год филиала завода по подготовке конденсата к транспорту Мангал (Марс)
Мангал (Марс) Я тебя любил
Я тебя любил Жизнь и творчество Ф.И. Тютчева
Жизнь и творчество Ф.И. Тютчева Презентация мини-музея Наш верный друг-собака
Презентация мини-музея Наш верный друг-собака Соотнеси звук с картиной дидактическая игра
Соотнеси звук с картиной дидактическая игра ООО Типографский комплекс Девиз
ООО Типографский комплекс Девиз Австралийский Союз
Австралийский Союз Дидактическая игра с использованием ИКТ Сложи слова.
Дидактическая игра с использованием ИКТ Сложи слова. Функции (виды функций и их графики)
Функции (виды функций и их графики) Домашняя аптечка
Домашняя аптечка