Содержание
- 2. Химическая кинетика – раздел химии, изучающий скорость и механизм химических реакций.
- 3. Системы: Гомогенные (однородные) – системы, в которых не видна поверхность раздела между компонентами. Газовые смеси, растворы.
- 4. Реакции: Гомогенные – реакции, протекающие в гомогенных системах. Протекают во всем объеме системы. Гетерогенные– реакции, протекающие
- 5. Скорость химической реакции - изменение концентрации одного из реагирующих веществ за единицу времени в единице объёма.
- 6. Влияние площади соприкосновения реагирующих веществ на скорость реакции. 1. Скорость гетерогенных реакций зависит от площади соприкосновения
- 7. Молярная концентрация – показывает количество молей вещества, находящееся в 1 литре. С = n / V
- 8. Задание 1. 1.В сосуде объёмом 5 литров находится 1 моль водорода. Рассчитайте молярную концентрацию водорода. 2.
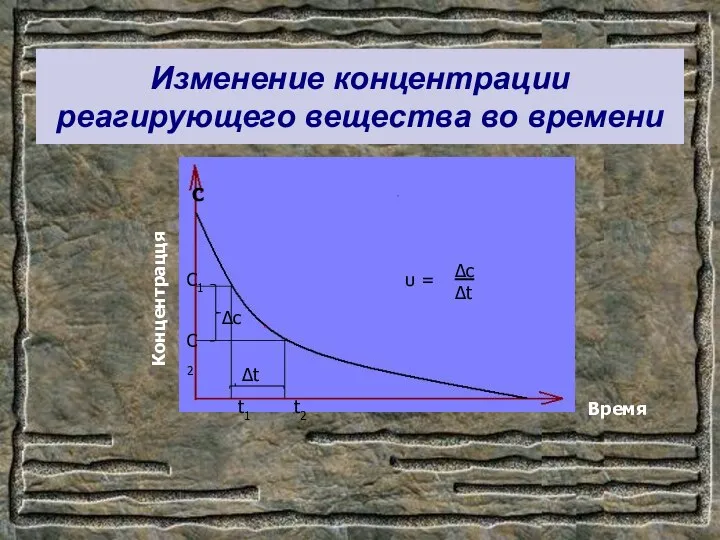
- 9. Изменение концентрации реагирующего вещества во времени С Концентрацця Время С1 С2 t1 t2 ∆c ∆t υ
- 10. Факторы, влияющие на скорость реакции 1. Концентрация реагирующих веществ. 2.Температура. 3. Природа реагирующих веществ. 4. Площадь
- 11. Влияние концентрации реагирующих веществ на скорость реакции. Чем больше концентрация реагирующих веществ, тем чаще сталкиваются частицы
- 12. Закон действия масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степени стехиометрических коэффициентов.
- 13. mА + nB = AmBn υ = k٠САm٠CBn k – константа скорости реакции: k = υ,
- 14. Запишите выражение ЗДМ для реакций: 2СО + О2 = 2СО2 N2 + 3H2 = 2NH3 4P
- 15. Расчетные задачи: 2. Во сколько раз необходимо повысить давление в системе: N2(г) + 3H2(г) → 2NH3(г),
- 16. Температура. Правило Вант-Гоффа: при повышении температуры на каждые 100С скорость большинства реакций увеличивается в 2 –
- 17. Расчетные задачи: Как изменится скорость некоторой реакции при уменьшении температуры 300С до 00С, если температурный коэффициент
- 18. Влияние температуры на скорость реакции. При повышении температуры, увеличивается скорость движения частиц, поэтому они чаще сталкиваются,
- 19. Влияние природы реагирующих веществ на скорость реакции. 2К+2Н2О=2КОН+Н2↑ 2Н2+О2=2Н2О
- 20. Влияние природы реагирующих веществ на скорость реакции. Са+2Н2О=Са(ОН)2+Н2↑
- 21. Влияние природы реагирующих веществ на скорость реакции. Чем активнее вещество, тем скорость реакции с его участием
- 22. Взаимодействие металлов с кислотами Zn + 2HCl = ZnCl2 + H2↑ υ 1 Fe + 2HCl
- 23. Влияние площади соприкосновения реагирующих веществ на скорость реакции. 1. Скорость гетерогенных реакций зависит от площади соприкосновения
- 24. Влияние площади соприкосновения реагирующих веществ на скорость реакции. Чем больше поверхность соприкосновения веществ, тем больше скорость
- 25. Влияние катализатора на скорость реакции. Катализаторами называются вещества, изменяющие скорость химических реакций. Химические реакции, протекающие при
- 26. Влияние катализатора на скорость реакции. С12Н22О11 + 12О2 = 12СО2+11Н2О
- 27. Механизм каталитических реакций Для реакции: А + В = АВ Механизм: Катализатор взаимодействует с исходным веществом:
- 28. Как необходимо изменить условия в системе: 2SO2(г) + O2(г) ↔ 2SO3(г) + Q, находящейся в равновесии,
- 30. Скачать презентацию


























 Отдел по работе с операторами (1)
Отдел по работе с операторами (1) Моя малая родина
Моя малая родина Функциональные ряды Степенные ряды. (Семинар 27)
Функциональные ряды Степенные ряды. (Семинар 27) Самопрезентация
Самопрезентация Северная Америка
Северная Америка Патохарактерологические и социально-психологические факторы формирования агрессивного и делинквентного поведения у подростков
Патохарактерологические и социально-психологические факторы формирования агрессивного и делинквентного поведения у подростков Столыпинские реформы
Столыпинские реформы Вещества и явления в окружающем мире. 5 класс
Вещества и явления в окружающем мире. 5 класс Презентация к уроку по теме Кремний
Презентация к уроку по теме Кремний Введение в авиационную и ракетную технику
Введение в авиационную и ракетную технику Материалы для родительского собрания о законе об образовании
Материалы для родительского собрания о законе об образовании Правила дорожного движения. Буксировка механических транспортных средств
Правила дорожного движения. Буксировка механических транспортных средств Народы севера
Народы севера Гирудотерапия. Лечебное действие гирудотерапии
Гирудотерапия. Лечебное действие гирудотерапии Государственные ипотечные программы КП НО ДОМ.НН
Государственные ипотечные программы КП НО ДОМ.НН Развитие вычислительной техники. (11 класс)
Развитие вычислительной техники. (11 класс) Педагогические технологии
Педагогические технологии 'Здоровьесберегающие технологии, используемые в образовательном процессе'
'Здоровьесберегающие технологии, используемые в образовательном процессе' Алеся Гутова
Алеся Гутова Образовательная политика в России. Основные направления модернизации образования
Образовательная политика в России. Основные направления модернизации образования Презентация к дистанционному уроку Типы химических реакций на примере свойств воды. 8 класс
Презентация к дистанционному уроку Типы химических реакций на примере свойств воды. 8 класс Презентация Ииндивидуальный подход в обучении детей с ограниченными возможностями здоровья
Презентация Ииндивидуальный подход в обучении детей с ограниченными возможностями здоровья Формирование представлений ребенка о себе, через сюжетно – ролевую игру
Формирование представлений ребенка о себе, через сюжетно – ролевую игру Трудности в обучении: причины и способы решения
Трудности в обучении: причины и способы решения Портфолио воспитателя
Портфолио воспитателя Разработка хлебобулочных изделий из ржано-пшеничной муки повышенной биологической ценности
Разработка хлебобулочных изделий из ржано-пшеничной муки повышенной биологической ценности Артикуляционная гимнастика с биоэнергопластикой
Артикуляционная гимнастика с биоэнергопластикой Театральне мистецтво у 50-60 рр. ХХ століття
Театральне мистецтво у 50-60 рр. ХХ століття