Слайд 2

«Строение электронных оболочек атомов
химических элементов»
Слайд 3

Цель урока:
научиться составлять электронные
формулы атомов элементов первых
трех периодов ПСХЭ;
объяснять зависимость и закономер-
ные изменения свойств химических
элементов от электронного строения
их атомов.
Слайд 4

Электронная оболочка
Совокупность всех электронов в атоме,
окружающих ядро
Каждый электрон имеет свою
траекторию
движения и запас энергии
Электроны расположены на различном
расстоянии от ядра: чем ближе электрон к
ядру, тем он прочнее с ним связан, его труднее
вырвать из электронной оболочки
По мере удаления от ядра запас энергии
электрона увеличивается, а связь с ядром
становится слабее
Слайд 5

Форма электронных
облаков (орбиталей)
Орбиталь – это область наиболее вероят- ного местонахождения
электрона в прост- ранстве
Слайд 6
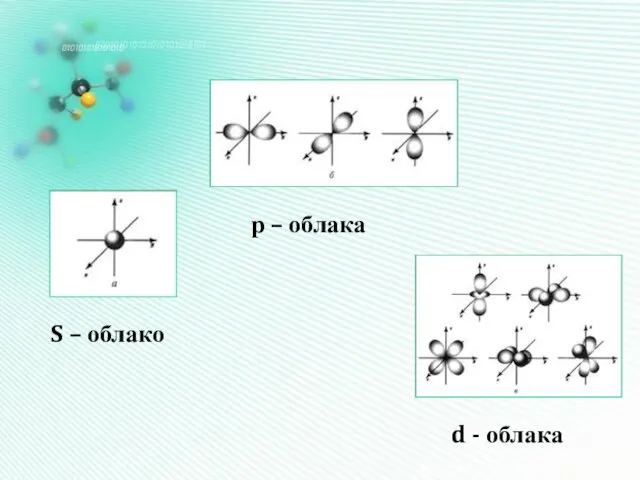
S – облако
р – облака
d - облака
Слайд 7

Алгоритм составления
электронных формул
Записываем знак химического элемента и
заряд ядра его
атома – он равен порядковому
номеру элемента.
Определяем количество энергетических
уровней (оно равно номеру периода) и коли-
чество электронов на каждом уровне.
Составляем электронную схему и формулу.
Слайд 8
Слайд 9
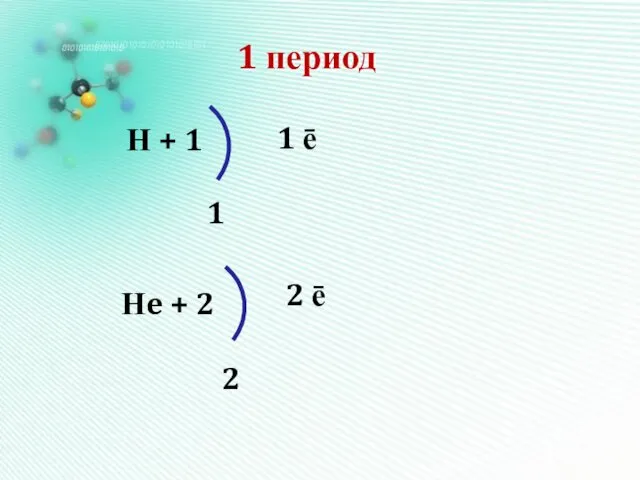
1 период
Н + 1
2 ē
1
1 ē
Нe + 2
2
Слайд 10
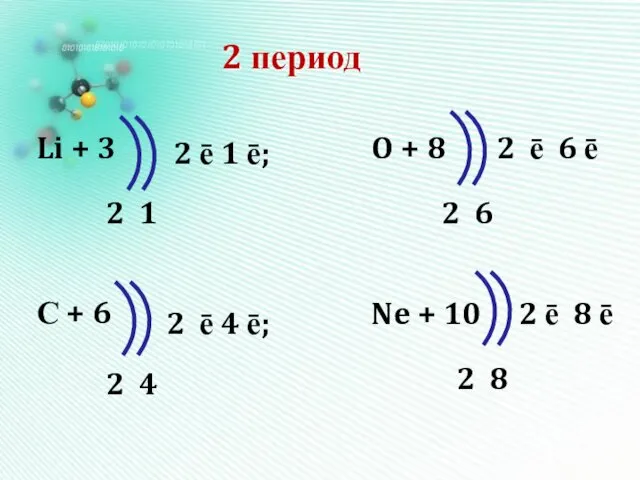
2 период
Li + 3
С + 6
O + 8
Ne + 10
2 1
2
6
2 4
2 8
2 ē 1 ē;
2 ē 6 ē
2 ē 4 ē;
2 ē 8 ē
Слайд 11
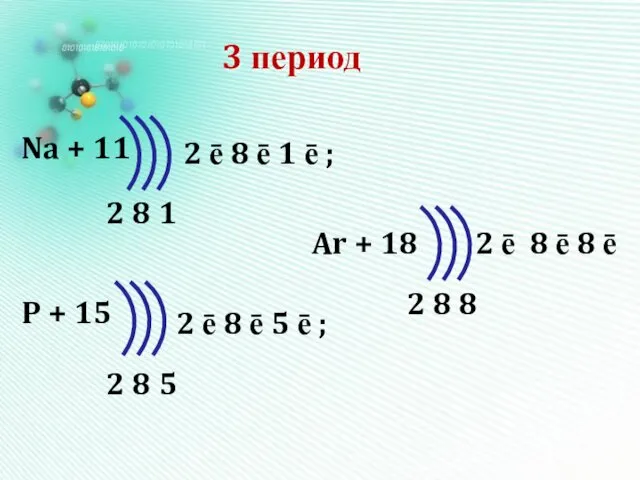
3 период
Na + 11
P + 15
Ar + 18
2 8 1
2 8
5
2 8 8
2 ē 8 ē 1 ē ;
2 ē 8 ē 5 ē ;
2 ē 8 ē 8 ē
Слайд 12
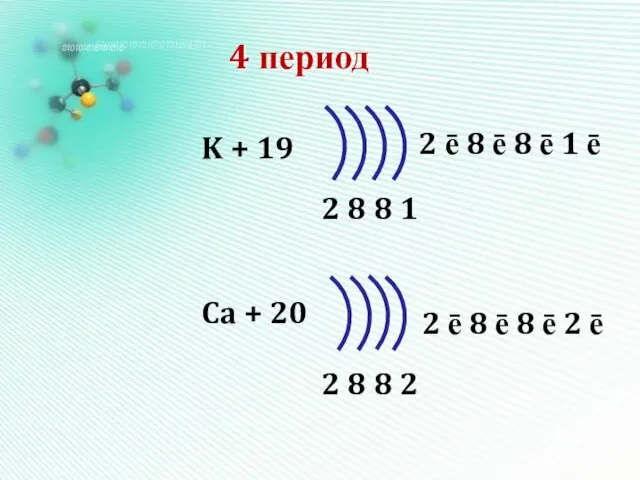
4 период
K + 19
Ca + 20
2 8 8 1
2 8
8 2
2 ē 8 ē 8 ē 1 ē
2 ē 8 ē 8 ē 2 ē
Слайд 13

Слайд 14

Слайд 15

Слайд 16















 системно-деятельностный подход Диск
системно-деятельностный подход Диск Написание безударных суффиксов глагола в форме прошедшего времени
Написание безударных суффиксов глагола в форме прошедшего времени Кл. час 02.02.22 Достижения российской науки
Кл. час 02.02.22 Достижения российской науки Ауыру. Оның құрылымы, механизмі, өткізу жолдары, ағзаның ауыру сезіміне реакциясы
Ауыру. Оның құрылымы, механизмі, өткізу жолдары, ағзаның ауыру сезіміне реакциясы Специфика работы с детьми с ЗПР в условиях общеобразовательной школы
Специфика работы с детьми с ЗПР в условиях общеобразовательной школы Ароматические углеводороды
Ароматические углеводороды Термодинамические и газодинамические основы теории турбомашин
Термодинамические и газодинамические основы теории турбомашин Многофункциональное пособие
Многофункциональное пособие Жизнь на Земле
Жизнь на Земле ОАО Автоваз. Финансовая политика
ОАО Автоваз. Финансовая политика Лекция 1. Введение в бизнес-планирование
Лекция 1. Введение в бизнес-планирование Презентация к выступлению:Совершенствование языковой и речевой компетенции педагогов.
Презентация к выступлению:Совершенствование языковой и речевой компетенции педагогов. Основы технологии сушки керамического кирпича-сырца
Основы технологии сушки керамического кирпича-сырца Дидактические игры по УМК своими руками
Дидактические игры по УМК своими руками Оснастка обсадных колонн. (Лекция 2)
Оснастка обсадных колонн. (Лекция 2) Проект развития застройки городской территории. Реконструкция квартала
Проект развития застройки городской территории. Реконструкция квартала Жедел бүйрек жеткіліксіздігі
Жедел бүйрек жеткіліксіздігі Считывание и фильтрация данных с платы TRB3
Считывание и фильтрация данных с платы TRB3 Электрические машины постоянного тока (продолжение)
Электрические машины постоянного тока (продолжение) Открытое акционерное общество Борисовский завод агрегатов
Открытое акционерное общество Борисовский завод агрегатов Особенности организации проектной деятельности в детском саду.
Особенности организации проектной деятельности в детском саду. Общественный контроль, как механизм противодействия коррупций
Общественный контроль, как механизм противодействия коррупций Компетентностно - ориентированные задания.
Компетентностно - ориентированные задания. Внеклассное мерприятие Особенности поведения зимой в лесу
Внеклассное мерприятие Особенности поведения зимой в лесу Карта России
Карта России Электронная игра Подбери по форме и цвету
Электронная игра Подбери по форме и цвету Классный час Россия - Родина моя. Символы России.
Классный час Россия - Родина моя. Символы России. Опасность сигарет
Опасность сигарет