Содержание
- 2. Апоптоз — форма гибели клетки, проявляющаяся в уменьшении ее размера, конденсации и фрагментации хроматина, уплотнении наружной
- 3. Исследования феномена программируемой клеточной смерти начались с конца 1960-х годов. Одним из первых в данной области
- 4. Для чего нужен апоптоз? Одной из основных функций апоптоза является уничтожение дефектных клеток. В многоклеточных организмах
- 5. Механизм гормоны; антигены; моноклональные антитела и др.
- 8. Несмотря на разнообразие инициирующих факторов, выделяются два основных пути трансдукции сигнала апоптоза: 1)рецептор-зависимый сигнальный путь с
- 9. Основные направления разрушительного действия каспаз на клетку: Инактивация ингибиторов апоптотических белков: CAD (каспазактивированная ДНК-аза) соединена с
- 10. Механизм регуляции с помощью цитокинов (путь «рецепторов смерти») Цитокины — группа белков, которые посредством связывания со
- 11. В настоящее время известно еще 4 специфических рецептора к белкам смерти (рецепторы смерти): TNFR1; DR3 (TRAMP,
- 12. Митохондриальный сигнальный путь
- 13. Раскрытие пор стимулируют следующие факторы: 1)неорганический фосфат; 2)каспазы; 3)SH-реагенты; 4)истощение клеток восстановленным глутатионом 5)образование активных форм
- 14. Цитохром c в цитоплазме клетки участвует в формировании апоптосомы вместе с белком APAF-1 («активирующий фактор апоптотической
- 15. К тому же открывается доступ CARD-домена APAF-1 для прокаспазы-9. В итоге происходит олигомеризация 7 субъединиц трансформированного
- 17. Эндоплазматический ретикулум и его роль в апоптозе эндоплазматический ретикулум (ЭР) рассматривается как участник индуцированного стрессом апоптоза
- 18. Другие индукторы апоптоза.
- 19. Причины апоптоза Феномен апоптоза является результатом действия различных факторов, приводящих к гибели клетки:
- 20. опухолевые заболевания аутоимунные заболевания нейродегенеративные заболевания Нога человека со сросшимися указательным и средним пальцами иллюстрирует результат
- 21. Заключение Апоптоз является генетически запрограммированным защитным механизмом, который направлен на запуск самоуничтожения патологически измененных, мутировавших клеток
- 22. Источники литературы Григорьев М. Ю. Апоптоз в норме и патологии / М. Ю. Григорьев, Е. Н.
- 24. Скачать презентацию
 Бас ми нервтері
Бас ми нервтері Эмбриональное развитие
Эмбриональное развитие Жұмыр құрттар
Жұмыр құрттар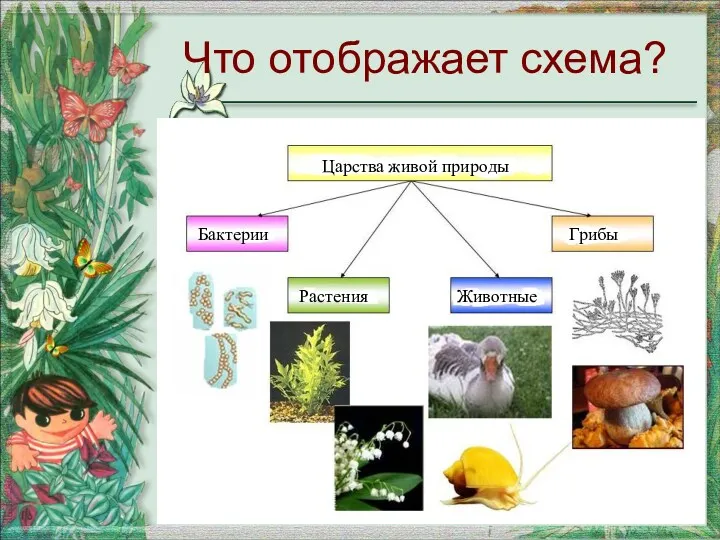 Царства живой природы
Царства живой природы Фармакогнозия. Краткая история фармакогностических исследований. Развитие европейской фармакогнозии
Фармакогнозия. Краткая история фармакогностических исследований. Развитие европейской фармакогнозии Сцепленное наследование генов
Сцепленное наследование генов Семейство Псовые, или Собачьи
Семейство Псовые, или Собачьи Биотические взаимоотношения
Биотические взаимоотношения Physiology of Bacteria
Physiology of Bacteria Презентация Семейства маслиновые
Презентация Семейства маслиновые Физиология растений. Лекция 3
Физиология растений. Лекция 3 Что изучает биохимия
Что изучает биохимия Строение клетки
Строение клетки Класс двудольные.Семейство пасленовые
Класс двудольные.Семейство пасленовые презентация по биологии Биотехнология
презентация по биологии Биотехнология Съедобные и ядовитые грибы. Правила сбора съедобных грибов
Съедобные и ядовитые грибы. Правила сбора съедобных грибов многообразие экосистем
многообразие экосистем Подснежники. Разновидности подснежников
Подснежники. Разновидности подснежников Красная книга
Красная книга Декоративные устройства для оформления объектов. Устройство и содержание цветников, вертикальное озеленение, каменистые участки
Декоративные устройства для оформления объектов. Устройство и содержание цветников, вертикальное озеленение, каменистые участки Рыбы. Строение рыбы
Рыбы. Строение рыбы DNA Replication
DNA Replication Передвижение веществ в организме растения
Передвижение веществ в организме растения Физиология высшей нервной деятельности. Формирование поведения в онтогенезе
Физиология высшей нервной деятельности. Формирование поведения в онтогенезе Путешествие маленьких икринок
Путешествие маленьких икринок Оценка иммунного статуса человека
Оценка иммунного статуса человека Проект о животных Красной книги Свердловской области: есть ли у них будущее?
Проект о животных Красной книги Свердловской области: есть ли у них будущее? Презентация к уроку биологии 8 класс по теме Витамины
Презентация к уроку биологии 8 класс по теме Витамины