1.Чему равен абсолютный нуль температуры, выраженный по шкале
Цельсия?
А. 0°С
Б. 100°С В. 273°С Г. -273°С
2.За нуль градусов по шкале Цельсия приняли:
А. Температуру таяния льда. Б. Температуру 273°С.
В. Температуру -273°С.
Г. Нет правильного ответа.
3.Можно ли обычным термометром измерить температуру одной кап
ли горячей воды?
А. Можно. Б. Нет. В. Можно, если термометр ртутный
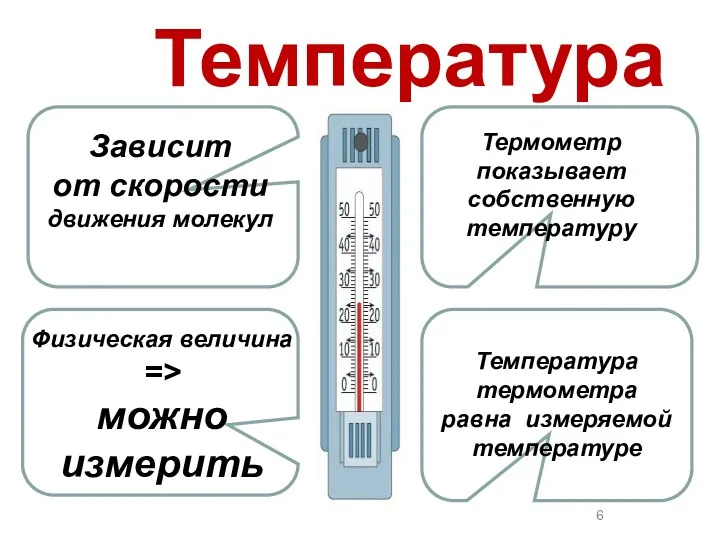
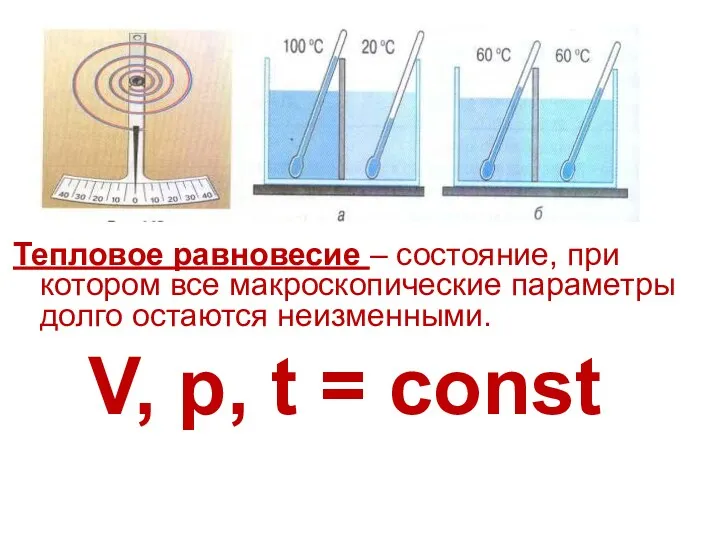
4.Температура у любых тел, находящихся в состоянии теплового равновесия:
А. Неодинакова. Б. Одинакова.
В. Может быть одинаковой или нет, в зависимости от теплоемкости тела.
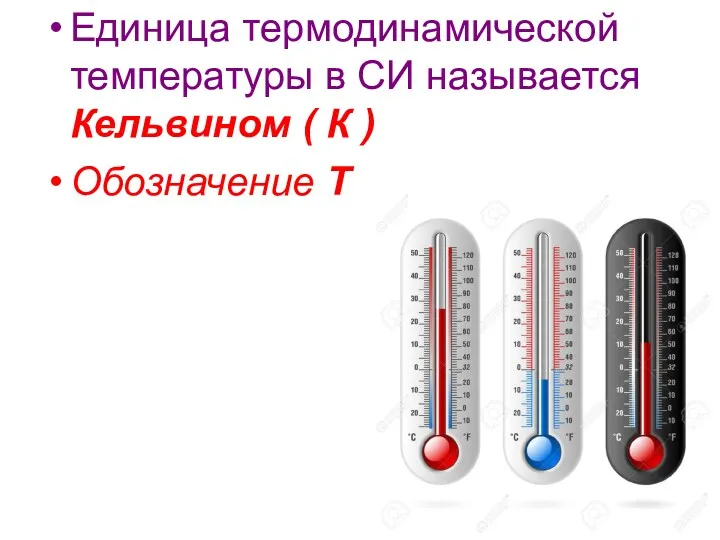
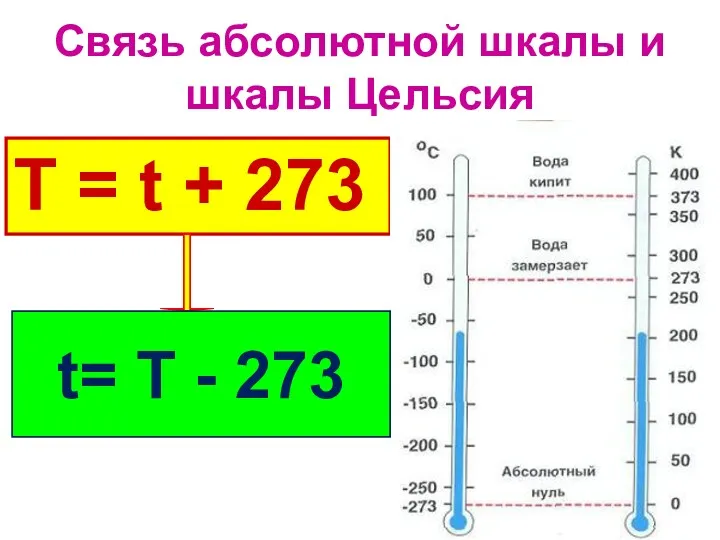
5.Какое существует соотношение между температурами по шкале
Цельсия и Кельвина?
А. Т = 273 + t Б. Т = 273 - t В. t = 273 + Т
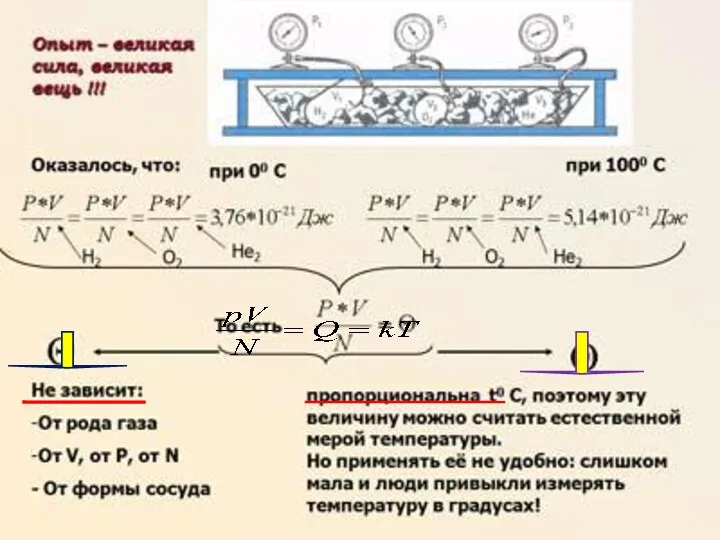
6. Какие физические параметры должны быть одинаковыми у тел, находящихся в тепловом равновесии?
А. Давление Б. Концентрация В.Температура Г. Объем.
Проверь себя











 Решение физических задач с применением производной функции
Решение физических задач с применением производной функции Наша машина Голдберга
Наша машина Голдберга Презентация Физический диктант. Электрическая цепь и её составные части
Презентация Физический диктант. Электрическая цепь и её составные части Презентация Звук
Презентация Звук Работа электрического тока. Мощность электрического тока. Единицы работы электрического тока, применяемые на практике
Работа электрического тока. Мощность электрического тока. Единицы работы электрического тока, применяемые на практике Реактивные движения в природе
Реактивные движения в природе Звук, инфразвук, ультразвук
Звук, инфразвук, ультразвук Проекитрование и производство изделий интегральной электроники. Диффузия примесей
Проекитрование и производство изделий интегральной электроники. Диффузия примесей Protein Structures: Thermodynamic aspects
Protein Structures: Thermodynamic aspects Техническое обслуживание системы смазки автомобиля двигателя ЗИЛ-4333
Техническое обслуживание системы смазки автомобиля двигателя ЗИЛ-4333 Всё для фронта, всё для победы!
Всё для фронта, всё для победы! Practical Look to Dynamic Stability
Practical Look to Dynamic Stability Интерференция, получаемая делением амплитуды
Интерференция, получаемая делением амплитуды Електричний струм у напівпровідниках
Електричний струм у напівпровідниках Альфа-, бета- и гамма-излучение. Радиоактивность
Альфа-, бета- и гамма-излучение. Радиоактивность Сообщающиеся сосуды
Сообщающиеся сосуды Небесное и земное в звуках и красках
Небесное и земное в звуках и красках Розробка і дослідження лабораторного стенду двигуна автомобіля Volkswagen В5
Розробка і дослідження лабораторного стенду двигуна автомобіля Volkswagen В5 Теплотехника. Основы теории тепло- и массообмена. (Лекция 11)
Теплотехника. Основы теории тепло- и массообмена. (Лекция 11) Теория механизмов и машин. Курс лекции
Теория механизмов и машин. Курс лекции Энергия и работа (лекция 6)
Энергия и работа (лекция 6) Внеклассное мероприятие по физике: Физический калейдоскоп
Внеклассное мероприятие по физике: Физический калейдоскоп Методика решения физических задач повышенной сложности
Методика решения физических задач повышенной сложности Виды излучений
Виды излучений Механические колебания
Механические колебания Електричне поле. Напруженість електричного поля
Електричне поле. Напруженість електричного поля Лампа накаливания
Лампа накаливания План – конспект урока - путешествия в 7 классе по теме Первоначальные сведения о строении веществ
План – конспект урока - путешествия в 7 классе по теме Первоначальные сведения о строении веществ