Содержание
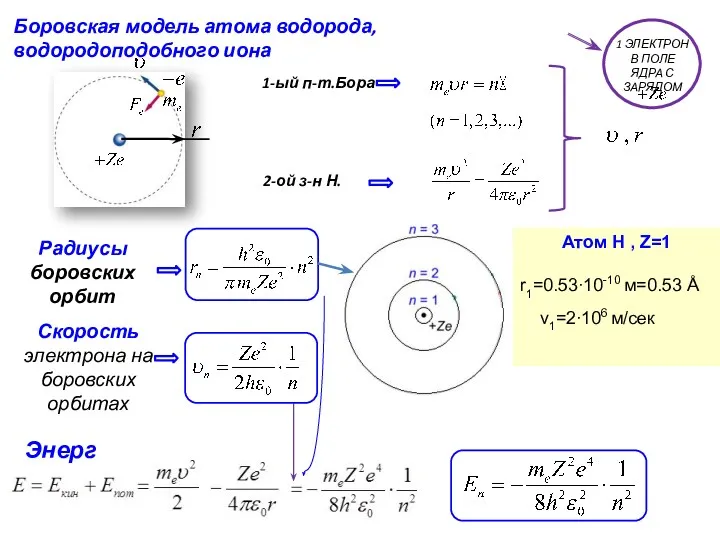
- 2. Боровская модель атома водорода, водородоподобного иона 2-ой з-н Н. Радиусы боровских орбит Энергия Атом Н ,
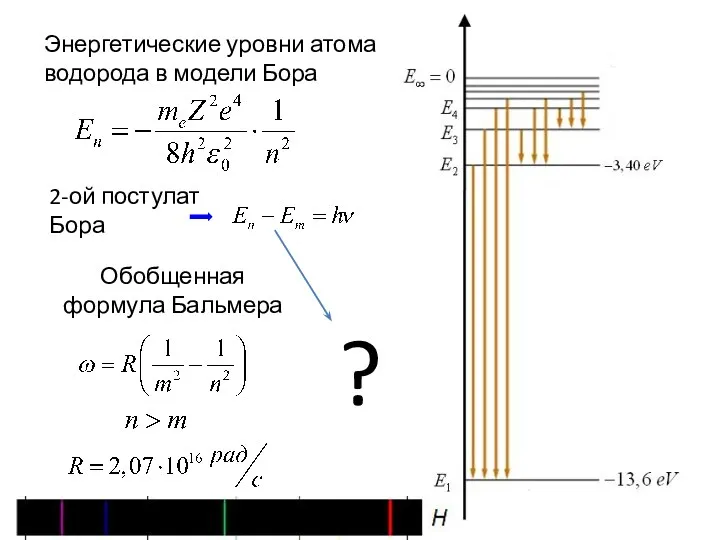
- 3. Энергетические уровни атома водорода в модели Бора
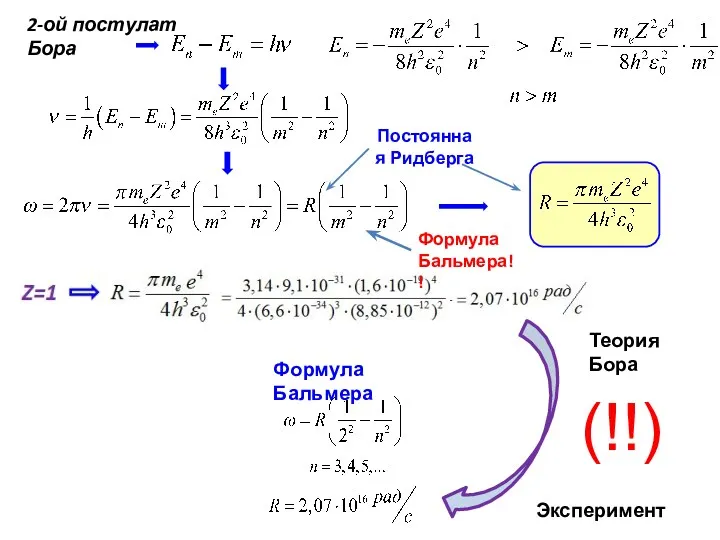
- 4. Постоянная Ридберга Теория Бора Эксперимент (!!) Формула Бальмера!!
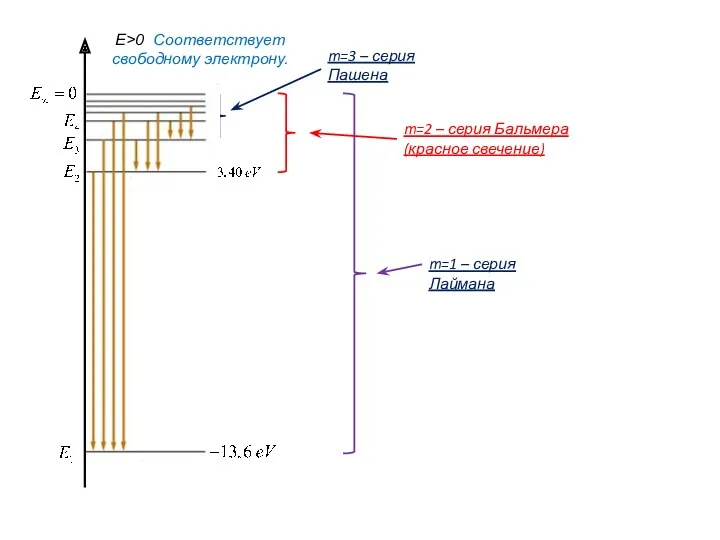
- 5. m=2 – серия Бальмера (красное свечение) m=1 – серия Лаймана m=3 – серия Пашена E>0 Соответствует
- 6. Недостатки теории Бора Не удаётся рассчитать атомы с двумя (атом Не) и более электронами. Основной недостаток
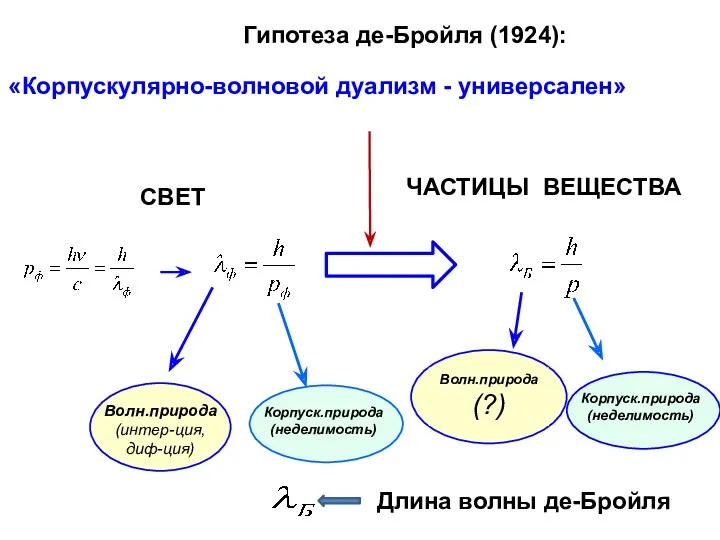
- 8. Гипотеза де-Бройля (1924): «Корпускулярно-волновой дуализм - универсален» СВЕТ Волн.природа (?) Длина волны де-Бройля
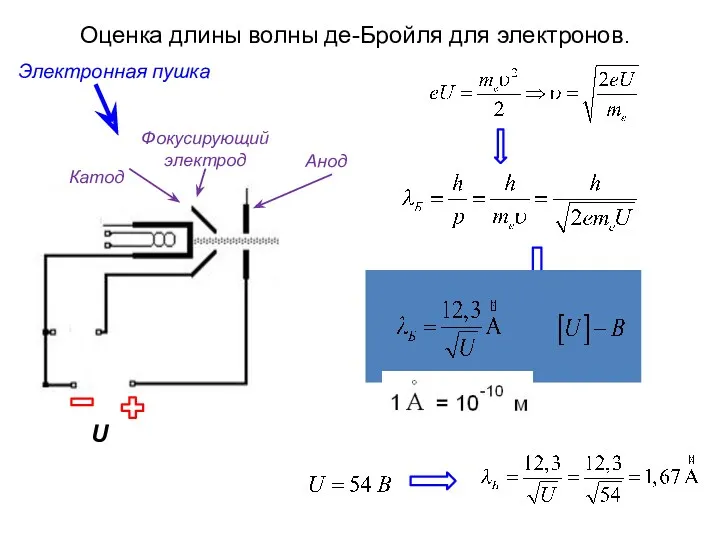
- 9. Оценка длины волны де-Бройля для электронов. U Катод Анод Фокусирующий электрод Электронная пушка
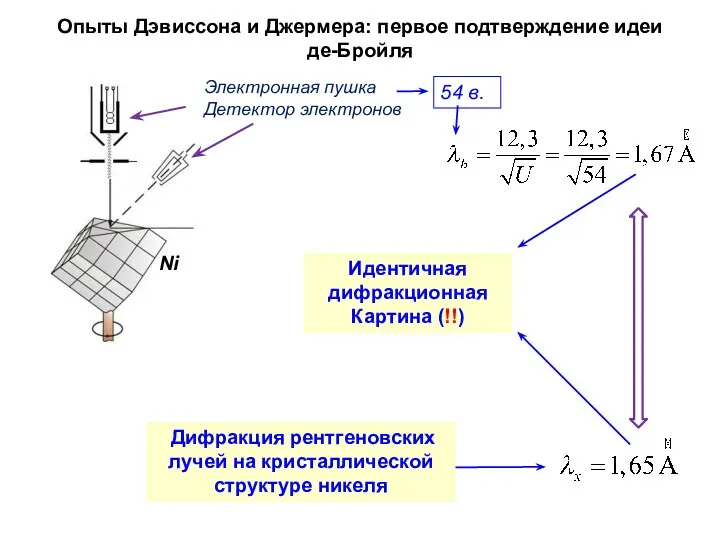
- 10. Опыты Дэвиссона и Джермера: первое подтверждение идеи де-Бройля Дифракция рентгеновских лучей на кристаллической структуре никеля Электронная
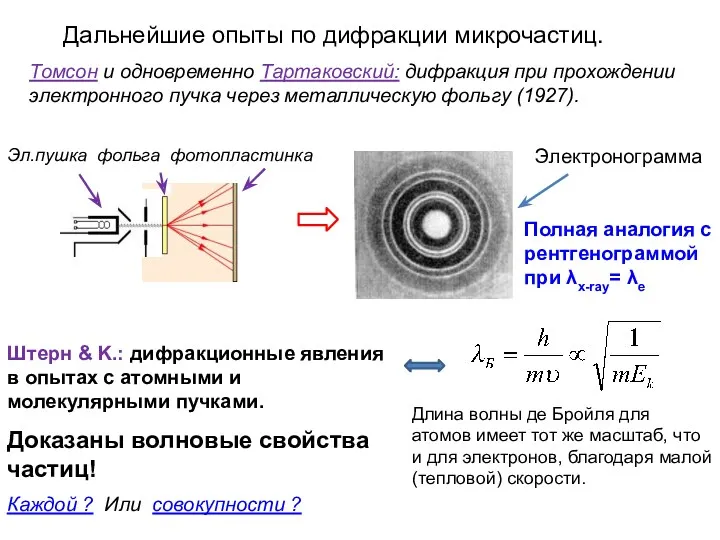
- 11. Дальнейшие опыты по дифракции микрочастиц. Томсон и одновременно Тартаковский: дифракция при прохождении электронного пучка через металлическую
- 12. Биберман, Сушкин и Фабрикант (1949): Опыты по дифракции электронов с пучками слабой интенсивности Электрон регистрировался как
- 13. Принцип неопределённости Гейзенберга (1927г). Гейзенберг, Вернер Карл (1901-1976)
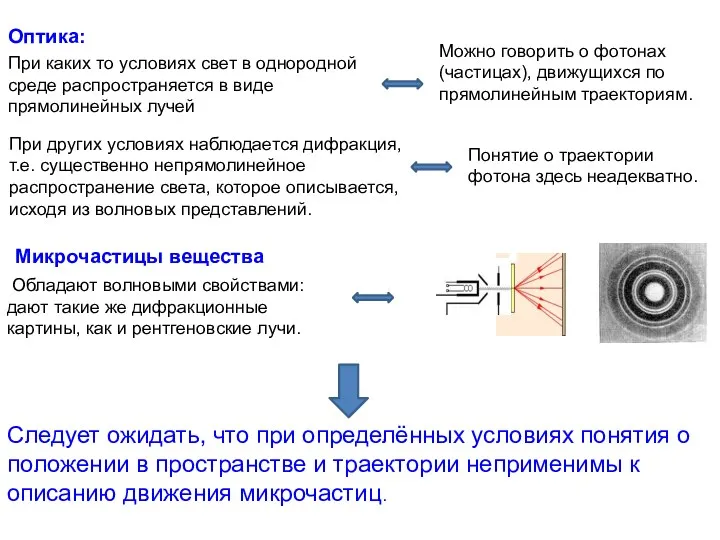
- 14. При каких то условиях свет в однородной среде распространяется в виде прямолинейных лучей При других условиях
- 15. Степень точности, с которой к частице может быть применено представление об её определённом положении в пространстве
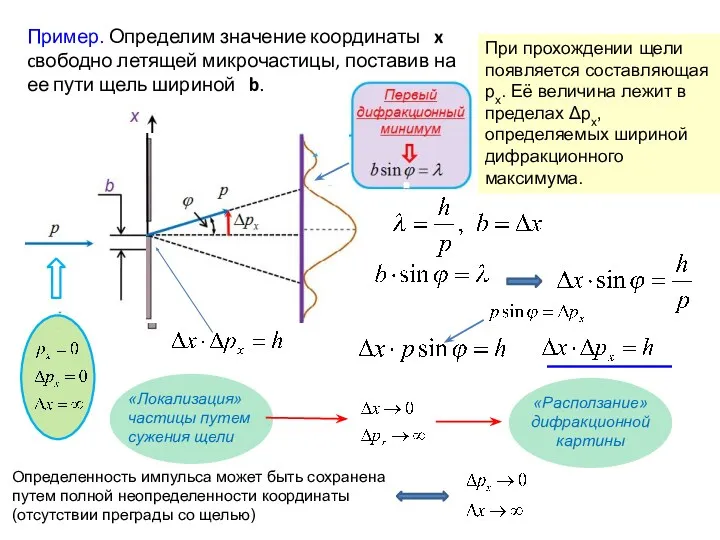
- 16. Пример. Определим значение координаты x cвободно летящей микрочастицы, поставив на ее пути щель шириной b. Определенность
- 17. Соотношение неопределенности указывает, насколько корректно применять классическую механику к объектам микромира Пример. Электрон в модели атома
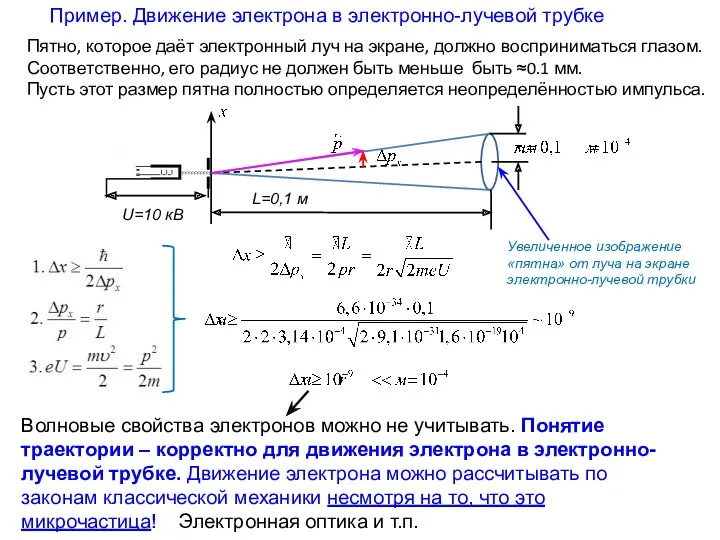
- 18. Пример. Движение электрона в электронно-лучевой трубке Увеличенное изображение «пятна» от луча на экране электронно-лучевой трубки Волновые
- 19. Пример. Движение электрона в электронно-лучевой трубке Увеличенное изображение «пятна» от луча на экране электронно-лучевой трубки Волновые
- 20. Пример. Пылинка Пылинка – большая; у нее большая масса; она объект макромира и к ней применимы
- 21. Микрочастицы обладают волновыми свойствами. А именно, их положение в пространстве задаётся определённым вероятностным законом и этот
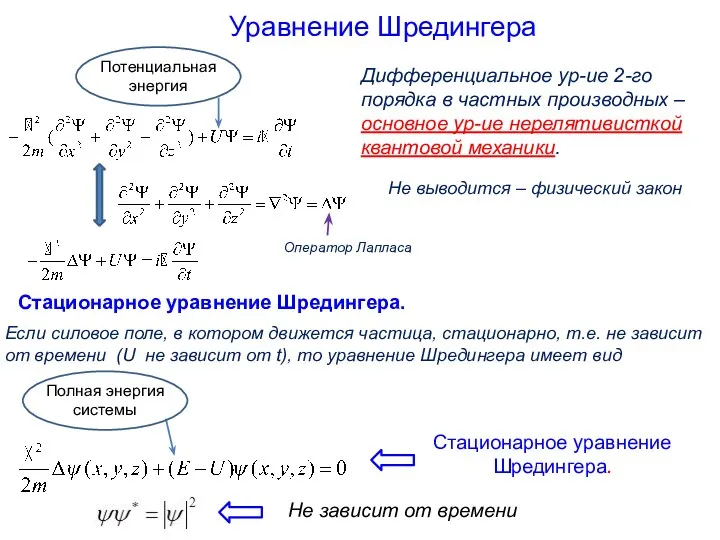
- 22. Уравнение Шредингера. Эрвин Шредингер (1887-1961)
- 23. Дифференциальное ур-ие 2-го порядка в частных производных – основное ур-ие нерелятивисткой квантовой механики. Оператор Лапласа Уравнение
- 24. Стационарное уравнение Шредингера. Если силовое поле, в котором движется частица, стационарно, т.е. не зависит от времени,
- 26. Скачать презентацию











 Элементы специальной теории относительности (СТО). Релятивистская кинематика
Элементы специальной теории относительности (СТО). Релятивистская кинематика Люминесценция: характеристики и законы
Люминесценция: характеристики и законы Явления смачивания
Явления смачивания Адсорбция изотермалары
Адсорбция изотермалары Успехи ученых-физиков МПГУ
Успехи ученых-физиков МПГУ Детали машин. Технологическая карта
Детали машин. Технологическая карта Звуковые волны. Скорость звука.
Звуковые волны. Скорость звука. Техника безопасности при использовании электрической энергии
Техника безопасности при использовании электрической энергии Передача давления жидкостями и газами. Закон Паскаля
Передача давления жидкостями и газами. Закон Паскаля Олимпийские игры и физика
Олимпийские игры и физика Виды теплопередач
Виды теплопередач Закон всемирного тяготения
Закон всемирного тяготения Изгиб. Основные понятия и допущения
Изгиб. Основные понятия и допущения Система подготовки учащихся к ОГЭ по физике
Система подготовки учащихся к ОГЭ по физике Техническая механика
Техническая механика Эксперимент – как метод активизации мыслительной деятельности учащихся на уроках физики
Эксперимент – как метод активизации мыслительной деятельности учащихся на уроках физики Оптика. Фотометрия. (Лекция 2)
Оптика. Фотометрия. (Лекция 2) Тепловые двигатели. КПД тепловых двигателей
Тепловые двигатели. КПД тепловых двигателей Радиографические методы
Радиографические методы Л_7_СК
Л_7_СК Магнит өрісі
Магнит өрісі Получение отверстий в металлических заготовках
Получение отверстий в металлических заготовках Амперметр. Измерение силы тока в цепи
Амперметр. Измерение силы тока в цепи Обобщающий урок-игра Физика 9 класс
Обобщающий урок-игра Физика 9 класс Изотопы 8,9 класс
Изотопы 8,9 класс Ерітінділердің коллигативті қасиеттері. Ерітінділер буының қысымы. Осмос қысымы
Ерітінділердің коллигативті қасиеттері. Ерітінділер буының қысымы. Осмос қысымы Конвективный теплообмен
Конвективный теплообмен Расчёт ферм
Расчёт ферм