Статистическое описание равновесных состояний. Функция распределения. Принцип детального равновесия. Распределение Максвелла презентация
Содержание
- 2. А.С. Чуев, 2020 Статистический метод — это вероятностный метод исследования систем из большого числа частиц. Данный
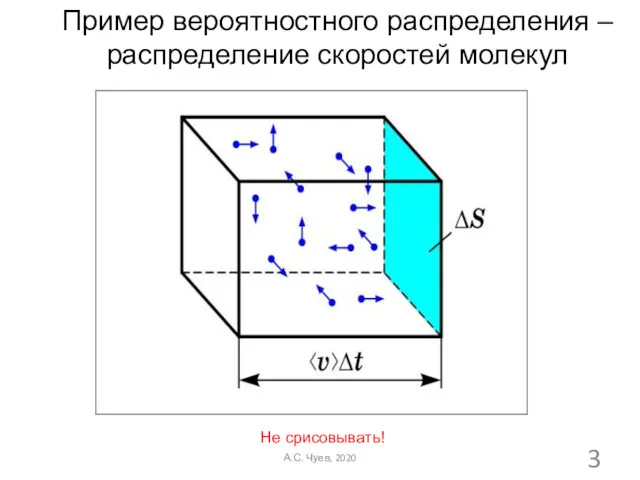
- 3. Не срисовывать! Пример вероятностного распределения – распределение скоростей молекул А.С. Чуев, 2020
- 4. Математическое определение вероятности: вероятность какого-либо события – это предел, к которому стремится отношение числа случаев, приводящих
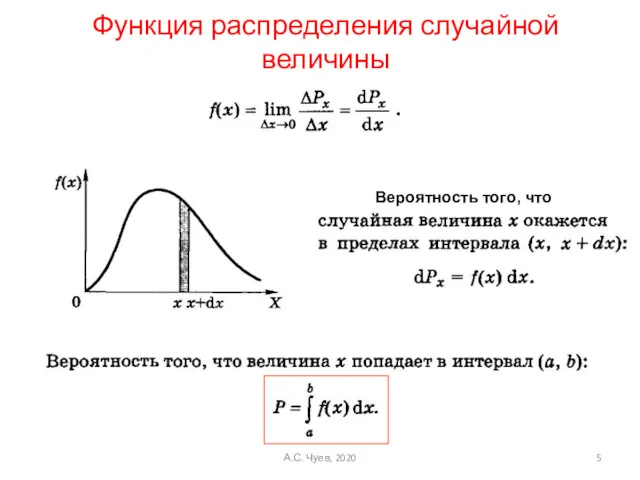
- 5. Функция распределения случайной величины Вероятность того, что А.С. Чуев, 2020
- 6. Для распределения молекул газа по скоростям: А.С. Чуев, 2020
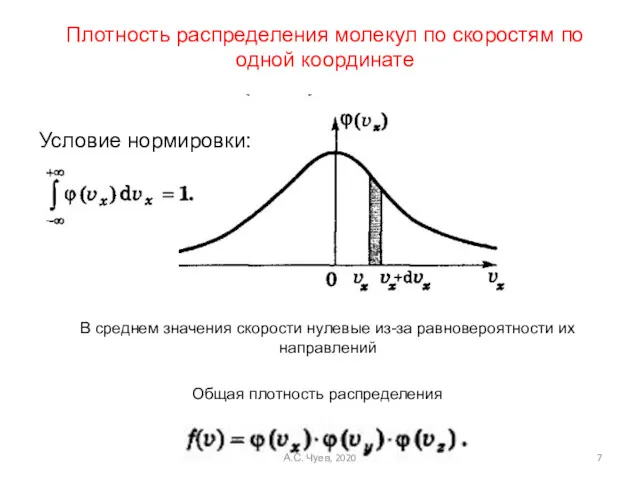
- 7. Условие нормировки: В среднем значения скорости нулевые из-за равновероятности их направлений Плотность распределения молекул по скоростям
- 8. Вид функции после нормировки: С учетом: Общая формула функции распределения скоростей по одной оси А.С. Чуев,
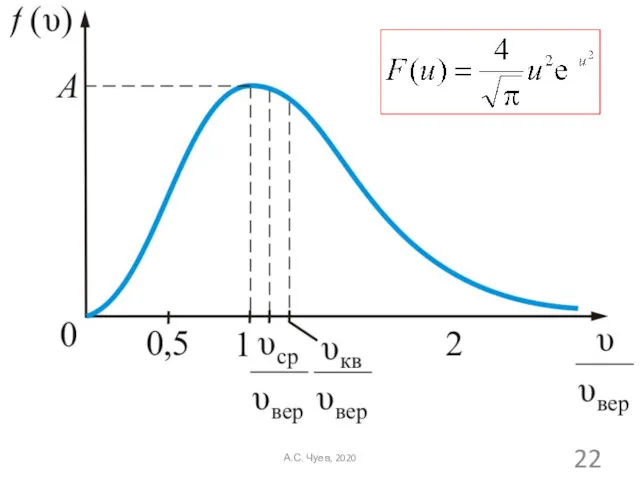
- 9. Функция распределения Максвелла по модулю скорости А.С. Чуев, 2020
- 10. А.С. Чуев, 2020
- 11. А.С. Чуев, 2020
- 12. Из С учетом Получаем закон распределения Максвелла по модулю скорости А.С. Чуев, 2020
- 13. и При изменении скорости эти изменения этих частей разнонаправленное А.С. Чуев, 2020
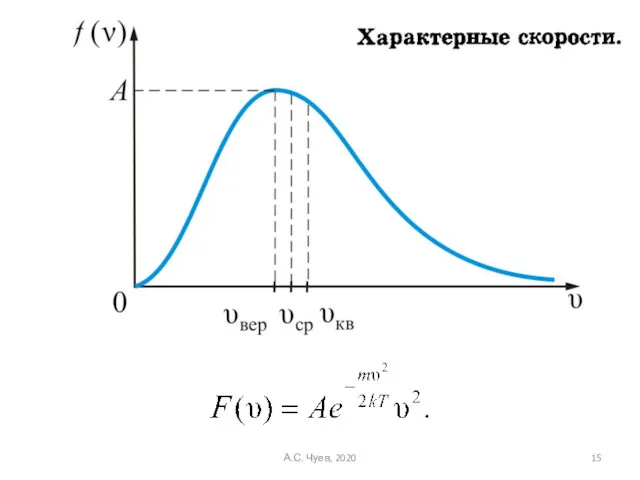
- 14. Данную функцию можно представить в виде: А.С. Чуев, 2020
- 15. А.С. Чуев, 2020
- 16. Факультативно (Из Савельева) Определение средних значений через плотности распределения А.С. Чуев, 2020
- 17. А.С. Чуев, 2020
- 18. Выводы из формулы: - Вид распределения молекул газа по скоростям, для каждого газа зависит от рода
- 19. Доска Гальтона А.С. Чуев, 2020
- 20. Формула Максвелла для относительных скоростей Для решения многих задач удобно использовать формулу Максвелла, где скорость выражена
- 21. В таком виде функция распределения не зависит ни от рода газа, ни от температуры Формула Максвелла
- 22. А.С. Чуев, 2020
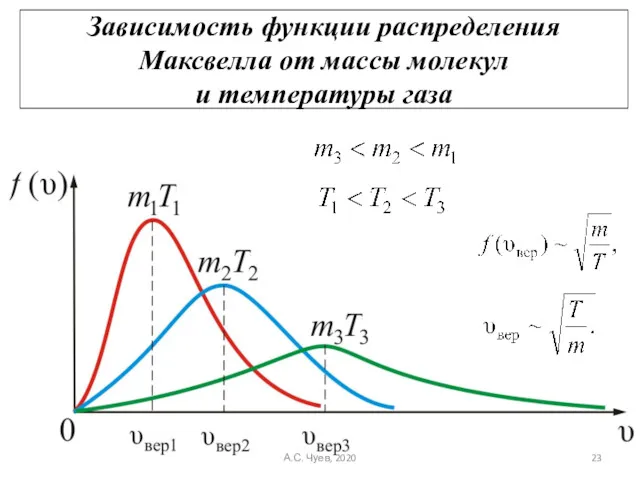
- 23. Зависимость функции распределения Максвелла от массы молекул и температуры газа А.С. Чуев, 2020
- 24. Распределение Больцмана для идеального газа во внешнем потенциальном поле. Барометрическая формула А.С. Чуев, 2020
- 25. Барометрическая формула Рассмотрим ещё один, очень важный закон. Атмосферное давление на какой-либо высоте h обусловлено весом
- 26. ρ - плотность газа на высоте h С = Р0 – давление на высоте . -
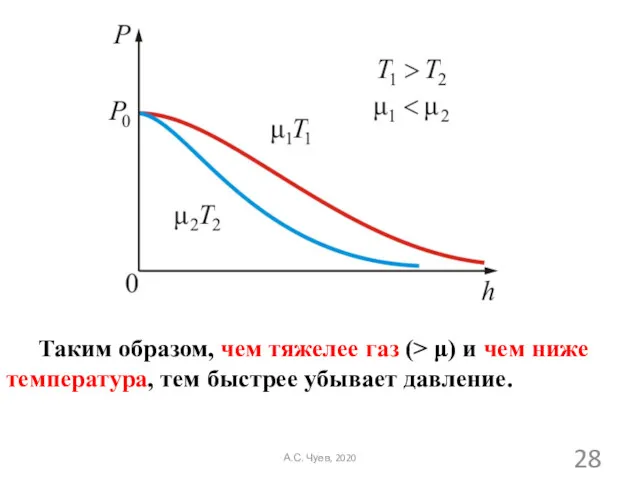
- 27. Из барометрической формулы следует, что P убывает с высотой тем быстрее, чем тяжелее газ (чем больше
- 28. Таким образом, чем тяжелее газ (> μ) и чем ниже температура, тем быстрее убывает давление. А.С.
- 29. Распределение Больцмана Распределение Больцмана определяет распределение частиц в силовом поле в условиях теплового равновесия. А.С. Чуев,
- 30. Пусть идеальный газ находится в поле консервативных сил, в условиях теплового равновесия. При этом, концентрация газа
- 31. Исходя из основного уравнения молекулярно-кинетической теории: , заменим P и P0 в барометрической формуле на n
- 32. А.С. Чуев, 2020
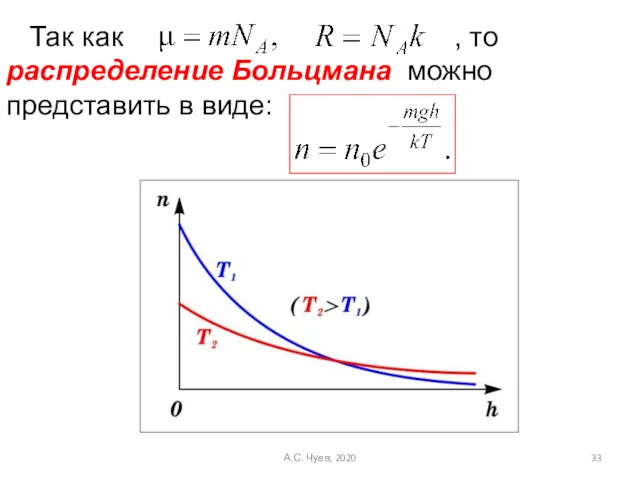
- 33. Так как , то распределение Больцмана можно представить в виде: А.С. Чуев, 2020
- 34. Так как –потенциальная энергия, следовательно, распределение Больцмана характеризует распределение частиц по значениям потенциальной энергии: – это
- 35. Больцман доказал, что это соотношение справедливо не только в потенциальном поле сил гравитации, но и в
- 36. Закон распределения Максвелла-Больцмана А.С. Чуев, 2020
- 37. А.С. Чуев, 2020
- 38. А.С. Чуев, 2020
- 39. Закон Максвелла-Больцмана в представлении через потенциальную и кинетическую энергии, имеет вид: А.С. Чуев, 2020
- 40. Закон распределения Максвелла-Больцмана в иной форме записи Здесь n0 – число молекул в единице объёма в
- 41. А.С. Чуев, 2020 Понятие о фазовом пространстве
- 42. А.С. Чуев, 2020 Двумерное фазовое пространство Квантом двумерного фазового пространства является постоянная Планка.
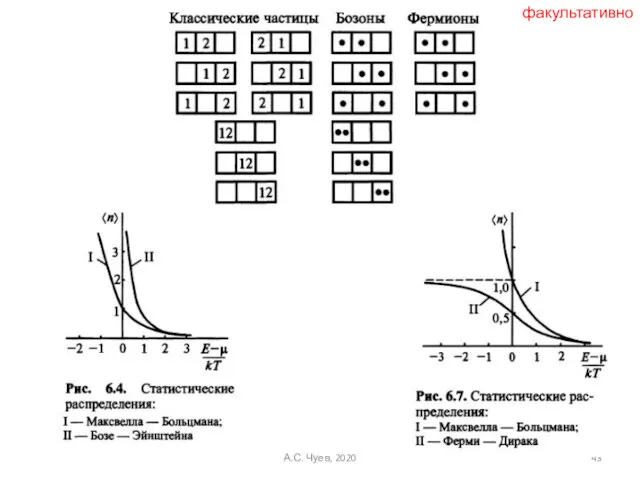
- 43. факультативно А.С. Чуев, 2020
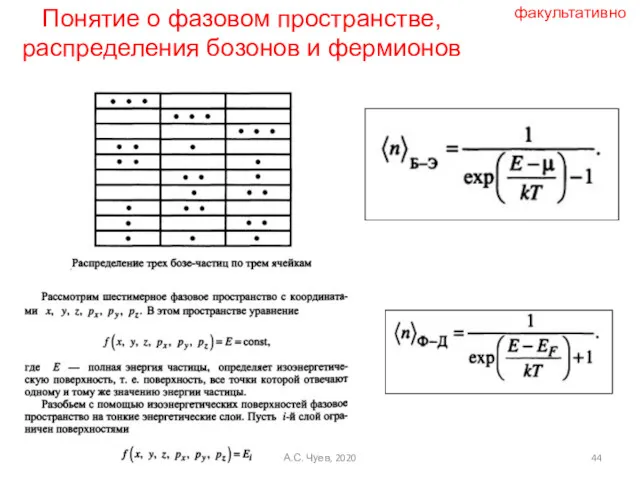
- 44. Понятие о фазовом пространстве, распределения бозонов и фермионов факультативно А.С. Чуев, 2020
- 45. Статистический смысл энтропии Различают понятия микро- и макросостояние термодинамической системы А.С. Чуев, 2020
- 46. Макросостояние – это состояние вещества, характеризуемое его термодинамическими параметрами. Состояние системы, характеризуемое состоянием каждой входящей в
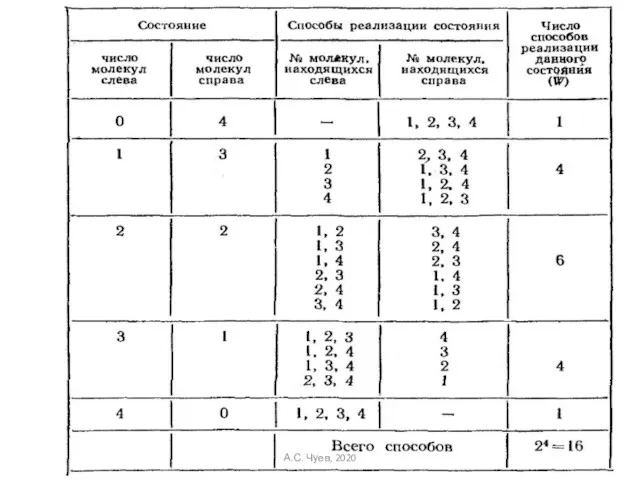
- 47. Термодинамической вероятностью или статистическим весом макросостояния W − называется число микросостояний, осуществляющих данное макросостояние (или число
- 48. В состоянии равновесия в термодинамике и вероятность максимальна и энтропия максимальна. Из этого можно сделать вывод,
- 49. Вероятность сложного события, есть произведение вероятностей где W1 – первое состояние; W2 – второе состояние. Аддитивной
- 50. Больцман предложил, что энтропия где k – коэффициент (постоянная) Больцмана. С этой точки зрения энтропия выступает,
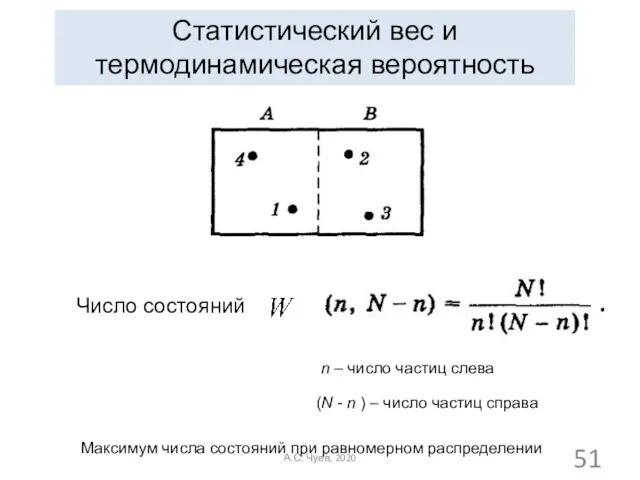
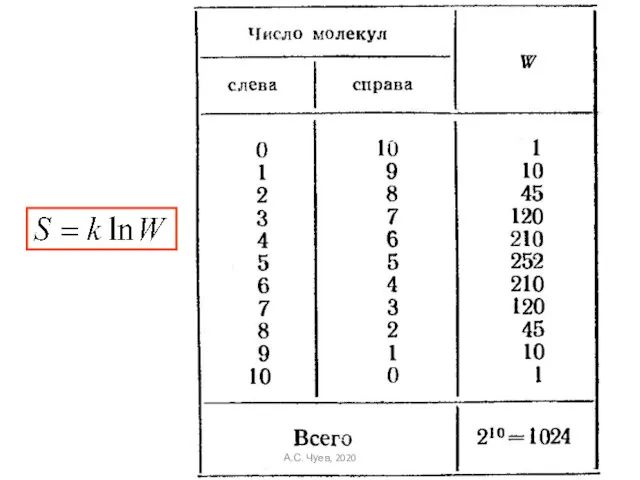
- 51. Статистический вес и термодинамическая вероятность n – число частиц слева (N - n ) – число
- 52. А.С. Чуев, 2020
- 53. А.С. Чуев, 2020
- 55. Скачать презентацию







































 Корабельные гироскопические системы. (Тема 2)
Корабельные гироскопические системы. (Тема 2) Взаимозаменяемость и нормирование точности
Взаимозаменяемость и нормирование точности Точность и погрешность измерений
Точность и погрешность измерений Основы теории подобия
Основы теории подобия Развитие средств связи
Развитие средств связи Тренажер по физике. Формулы.8 класс
Тренажер по физике. Формулы.8 класс Урок Обобщение материала по теме Силы в природе. 7 класс.
Урок Обобщение материала по теме Силы в природе. 7 класс. Плотность вещества
Плотность вещества Реактивное движение
Реактивное движение Пожежні автомобілі аеродромної служби
Пожежні автомобілі аеродромної служби Урок-презентация по теме Сила трения
Урок-презентация по теме Сила трения Поршневой жидкостный насос. Гидравлический пресс
Поршневой жидкостный насос. Гидравлический пресс Взаимодействие света с веществом. Лекция №8
Взаимодействие света с веществом. Лекция №8 Свободное падение тел
Свободное падение тел Управление колебаниями системы маятник-тележка с приводом методом скоростного биградиента
Управление колебаниями системы маятник-тележка с приводом методом скоростного биградиента Плотность вещества
Плотность вещества Магнитное поле и его характеристики
Магнитное поле и его характеристики Розв'язування задач з теми Сили в природі
Розв'язування задач з теми Сили в природі Испарение и конденсация. Кипение жидкости
Испарение и конденсация. Кипение жидкости Акустика как часть физики
Акустика как часть физики Какие батарейки лучше
Какие батарейки лучше Колебательные цепи при гармонических воздействиях. Лекция 5
Колебательные цепи при гармонических воздействиях. Лекция 5 Дифракция
Дифракция Опыт Карла Рикке
Опыт Карла Рикке Акустика. Слух и его свойства
Акустика. Слух и его свойства способы изм. вн. эн
способы изм. вн. эн Расчет переходных процессов в электрических цепях классическим методом
Расчет переходных процессов в электрических цепях классическим методом Плоские электромагнитные волны. Устройство и параметры однородных линий передач
Плоские электромагнитные волны. Устройство и параметры однородных линий передач