Содержание
- 2. Теория Бора для атома водорода и водородоподобных ионов Спектральные линии с одинаковым числом n=1,2,3,… и различ-ными
- 3. Теория Бора для атома водорода и водородоподобных ионов При увеличении m длина волны уменьшается, а частота
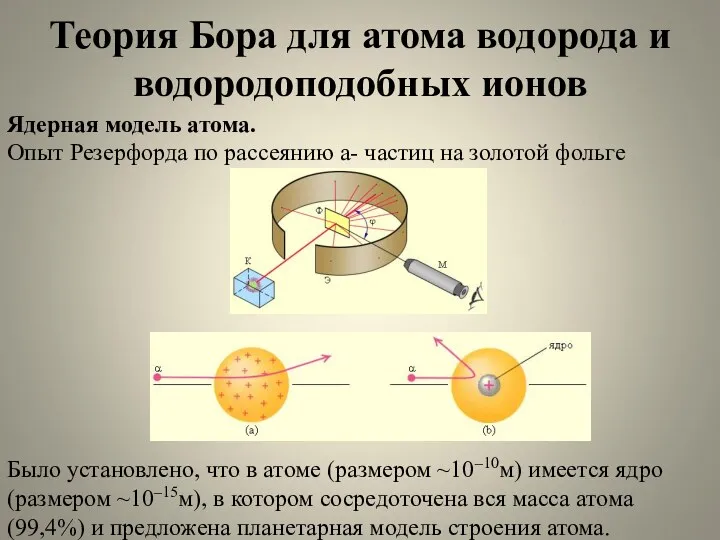
- 4. Теория Бора для атома водорода и водородоподобных ионов Ядерная модель атома. Опыт Резерфорда по рассеянию a-
- 5. Теория Бора для атома водорода и водородоподобных ионов Вокруг ядра с зарядом Ze ( Z–порядковый номер
- 6. Теория Бора для атома водорода и водородоподобных ионов Постулаты Бора Первый постулат Бора (постулат стационарных состояний):
- 7. Теория Бора для атома водорода и водородоподобных ионов Второй постулат Бора (правило частот). Любое изменение энергии
- 8. Теория Бора для атома водорода и водородоподобных ионов Второй закон Ньютона для электрона в водородоподобном ионе
- 9. Теория Бора для атома водорода и водородоподобных ионов Состояние атома с n=1 называется основным. Радиус первой
- 10. Теория Бора для атома водорода и водородоподобных ионов Угловая скорость электрона на орбите с номером n:
- 11. 5. Теория Бора для атома водорода и водородоподобных ионов Состояние с номером n=1 и энергией эВ
- 12. Теория Бора для атома водорода и водородоподобных ионов Полная энергия электрона отрицательна и соответствует ограничен-ному движению
- 13. Теория Бора для атома водорода и водородоподобных ионов Энергия связи данного состояния – энергия, необходимая для
- 14. Теория Бора для атома водорода и водородоподобных ионов Вывод формулы Бальмера в теории Бора Рассматривая первый
- 15. Волны де Бройля. Волны де Бройля Двойственная природа света Волновые свойства света - в явлениях интерференции,
- 16. Волны де Бройля. Волновые свойства электрона были впервые обнаружены в 1927 году. Наиболее наглядными явились опыты
- 17. Волны де Бройля. Дифракционная картина от пучка электронов на золотой фольге (слева) и рентгеновских лучей на
- 18. Волны де Бройля. Для определения длины волны, частоты и циклической частоты микрочастицы де Бройль использовал соответствующие
- 19. Волны де Бройля. Воспользовавшись соотношением для кинетической энергии , получим формулу: , выражающую дебройлевскую длину волны
- 20. Соотношения неопределенностей Гейзенберга. Поскольку микрочастица является волной, определить траекторию ее движения, т.е. одновременно задать ее положение
- 21. Соотношения неопределенностей Гейзенберга Вернер Гейзенберг, 1933 год 1901-1976
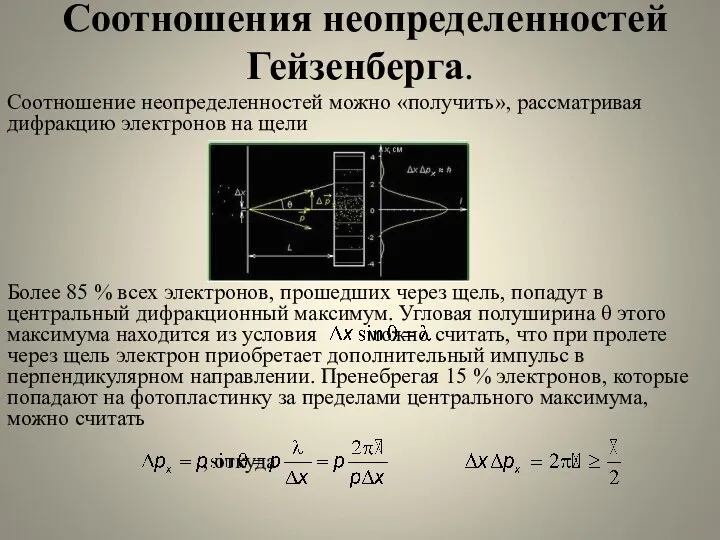
- 22. Соотношения неопределенностей Гейзенберга. Соотношение неопределенностей можно «получить», рассматривая дифракцию электронов на щели Более 85 % всех
- 23. Соотношения неопределенностей Гейзенберга. Следовательно, чем меньше неопределенность одной из величин ( или ), тем больше неопределенность
- 24. 7. Соотношения неопределенностей Гейзенберга. В квантовой механике существует также соотношение неопределен-ностей для энергии и времени: где
- 25. Соотношения неопределенностей Гейзенберга. В расчетах вместо точной формулировки используют приближен-ный вариант записи: и , что позволяет
- 26. Примеры решения задач Задача 1. Кинетическая энергия электрона в атоме водорода составляет величину порядка 10 эВ.
- 27. Примеры решения задач Задача 2. Электрон с кинетической энергией 4 эВ локализован в об-ласти размером 1
- 28. Примеры решения задач Задача 3. Оцените с помощью соотношения неопределенностей минимальную энергию электрона в атоме водорода
- 29. Примеры решения задач Задача 4. Используя соотношение неопределенности энергии и времени, найдите естественную ширину спектральной линии
- 31. Скачать презентацию


























 Стартер - назначение, устройство и принцип работы
Стартер - назначение, устройство и принцип работы Радиациялық сәулелену
Радиациялық сәулелену Газовые лазеры
Газовые лазеры Конденсатор. Электрическое поле
Конденсатор. Электрическое поле Молекулярная физика и термодинамика
Молекулярная физика и термодинамика Восстановление деталей синтетическими материалами
Восстановление деталей синтетическими материалами Механические колебания и волны
Механические колебания и волны Частотный метод синтеза корректирующего звена по ЛАЧХ разомкнутой системы
Частотный метод синтеза корректирующего звена по ЛАЧХ разомкнутой системы Строение атома. Планетарная модель и модель Бора. Испускание и поглощение света атомом
Строение атома. Планетарная модель и модель Бора. Испускание и поглощение света атомом Элементарны ли элементарные частицы?
Элементарны ли элементарные частицы? Комплект сборного расточного инструмента
Комплект сборного расточного инструмента Приборы для измерения давления
Приборы для измерения давления
 Спектроскопические методы анализа
Спектроскопические методы анализа Тема: Расчет разветвленной магнитной цепи
Тема: Расчет разветвленной магнитной цепи Элементы ядерной физики
Элементы ядерной физики Инфракрасное, ультрафиолетовое и рентгеновское излучения. Их свойства и применение
Инфракрасное, ультрафиолетовое и рентгеновское излучения. Их свойства и применение Кинематический и силовой расчет привода винтового толкателя
Кинематический и силовой расчет привода винтового толкателя Подготовка к ЕГЭ по физике.
Подготовка к ЕГЭ по физике. выступление в ЮурГУ
выступление в ЮурГУ Матеріали дипломної роботи. Електропостачання житлового мікрорайону міста Дрогобич
Матеріали дипломної роботи. Електропостачання житлового мікрорайону міста Дрогобич Газовые законы
Газовые законы Уравнения Максвелла. Закон полного тока
Уравнения Максвелла. Закон полного тока Методы анализа, основанные на поглощении электромагнитного излучения
Методы анализа, основанные на поглощении электромагнитного излучения Квазиравновесный конденсат поляритонов в GaAs микрорезонаторах в магнитном поле
Квазиравновесный конденсат поляритонов в GaAs микрорезонаторах в магнитном поле Материал и конструкция рабочих колес гидромашин
Материал и конструкция рабочих колес гидромашин Электромагнитная индукция
Электромагнитная индукция Естественное и искусственное освещение. Лекция 5
Естественное и искусственное освещение. Лекция 5