Содержание
- 2. ЭЛЕМЕНТЫ СТАТИСТИЧЕСКОЙ ФИЗИКИ
- 3. Основы классической статистики заложены Д.К.Максвеллом (Англия), Л.Больцманом (Германия), В.У.Гиббсом (США) во второй половине XIX столетия. Задачи
- 4. В средине XIX века была сформулирована молекулярно-кинетическая теория, но тогда не было никаких доказательств существования самих
- 5. Закономерности, обусловленные большим числом сталкивающихся атомов и молекул, и не свойственные отдельным атомам и молекулам, называются
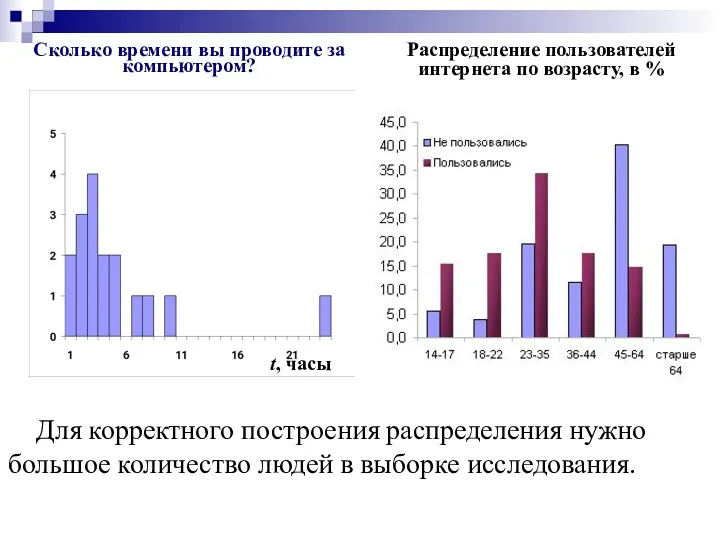
- 6. Сколько времени вы проводите за компьютером? t, часы Для корректного построения распределения нужно большое количество людей
- 7. 1. Распределение Максвелла (для описания распределения молекул по скоростям)
- 8. Обозначим: dN – число молекул со скоростями от υ до υ + dυ. N – общее
- 9. – условие нормировки функции распределения Интеграл определяет вероятность того, что скорость молекулы попадает в интервал скоростей
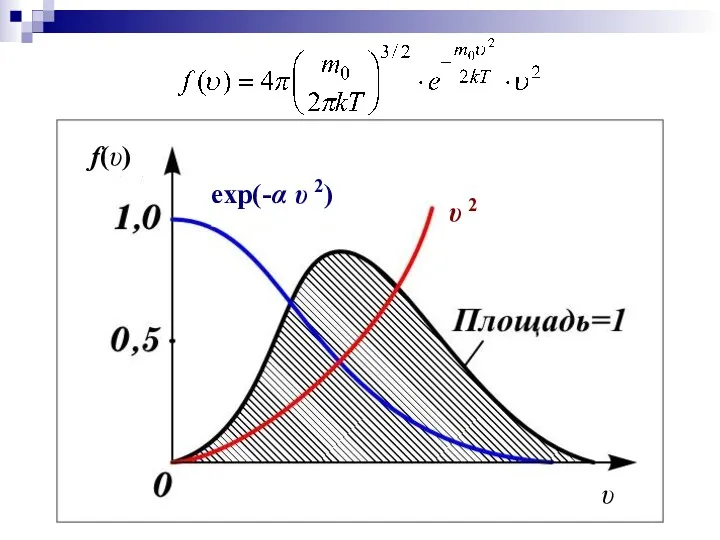
- 10. Явный вид функции f(υ) был получен теоретически Максвеллом в 1859 г. m0 – масса молекулы, Т
- 11. f(υ) υ υ 2 exp(-α υ 2)
- 12. Основные свойства функции распределения 1. При υ=0 и υ=∞ f (υ)=0 – очень большие и маленькие
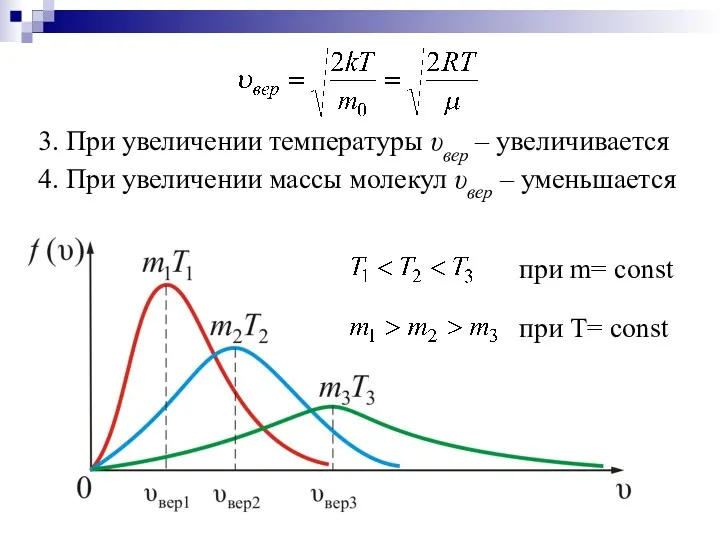
- 13. при Т= const при m= const 3. При увеличении температуры υвер – увеличивается 4. При увеличении
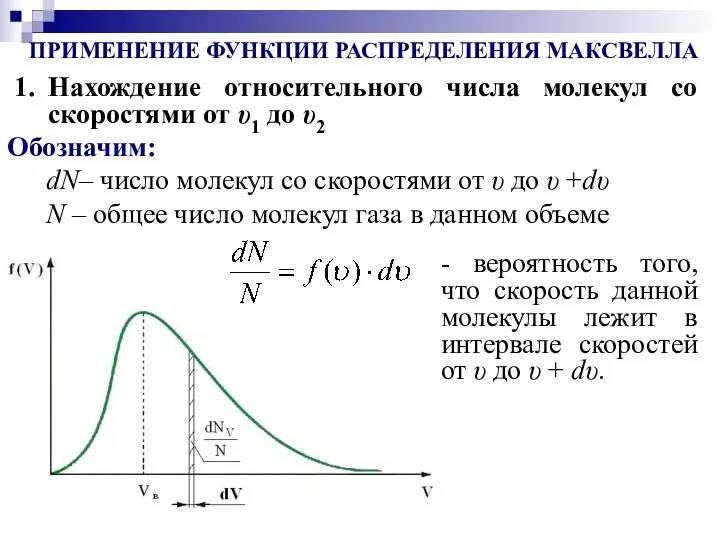
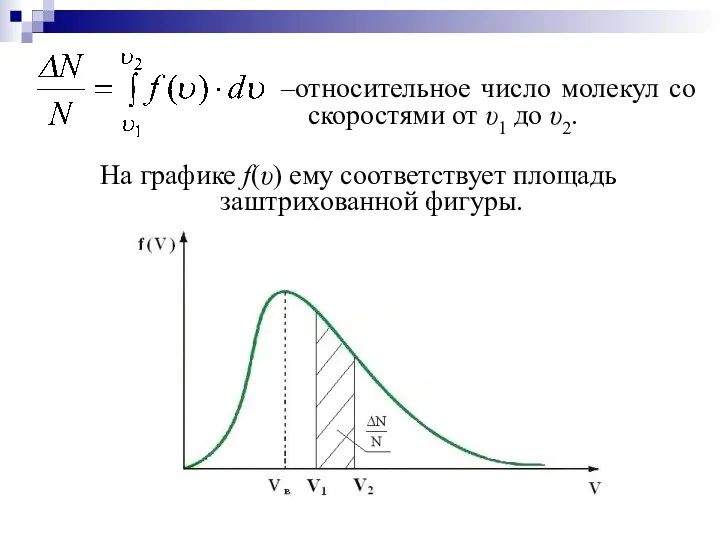
- 14. ПРИМЕНЕНИЕ ФУНКЦИИ РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА Нахождение относительного числа молекул со скоростями от υ1 до υ2 dN– число
- 15. –относительное число молекул со скоростями от υ1 до υ2. На графике f(υ) ему соответствует площадь заштрихованной
- 16. 2. Нахождение средней скорости молекул υср По определению: Разобьем весь интервал возможных скоростей (от нуля до
- 17. - сумма скоростей молекул, скорости которых лежат в интервале от υ до υ + Δ υ.
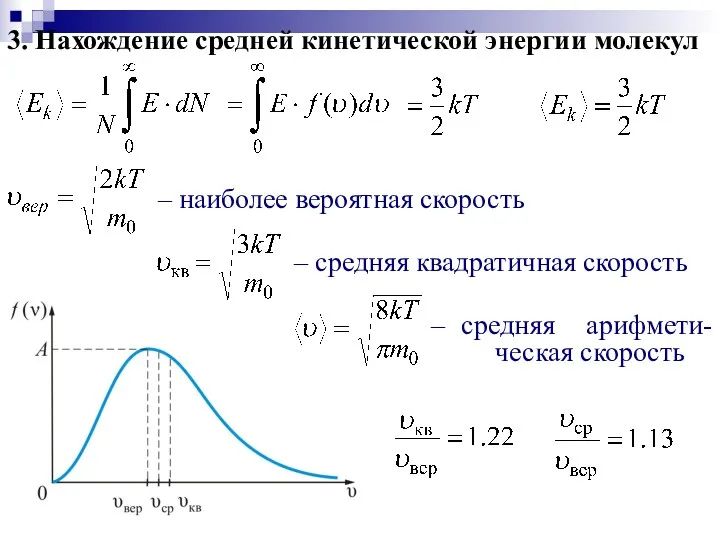
- 18. 3. Нахождение средней кинетической энергии молекул – наиболее вероятная скорость – средняя квадратичная скорость – средняя
- 19. 2. Распределение Больцмана (для описания распределения молекул по высоте в гравитационном поле Земли)
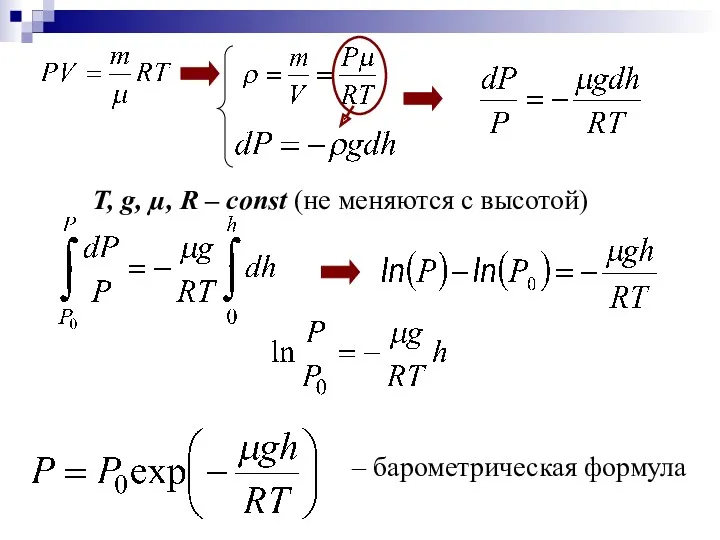
- 20. ИДЕАЛЬНЫЙ ГАЗ В ОДНОРОДНОМ ПОЛЕ ТЯГОТЕНИЯ БАРОМЕТРИЧЕСКАЯ ФОРМУЛА Барометрическая формула выражает зависимость атмосферного давления от высоты
- 21. Т, g, µ, R – const (не меняются с высотой) - дифференциальное уравнение, связывающее давление с
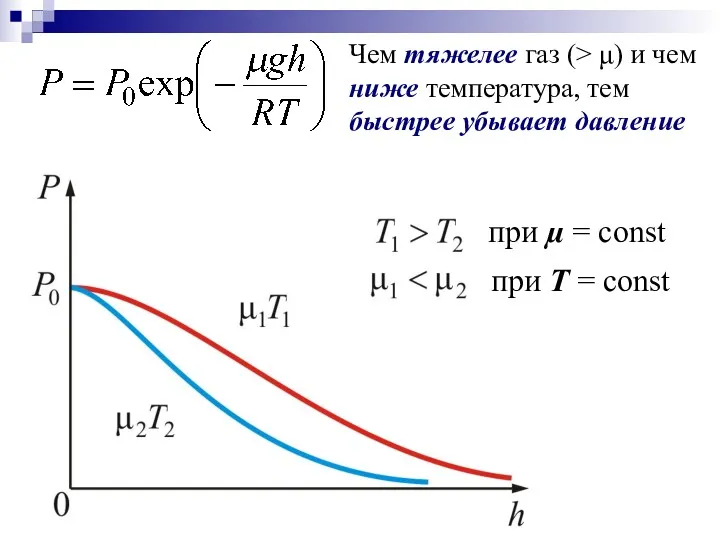
- 22. Чем тяжелее газ (> μ) и чем ниже температура, тем быстрее убывает давление
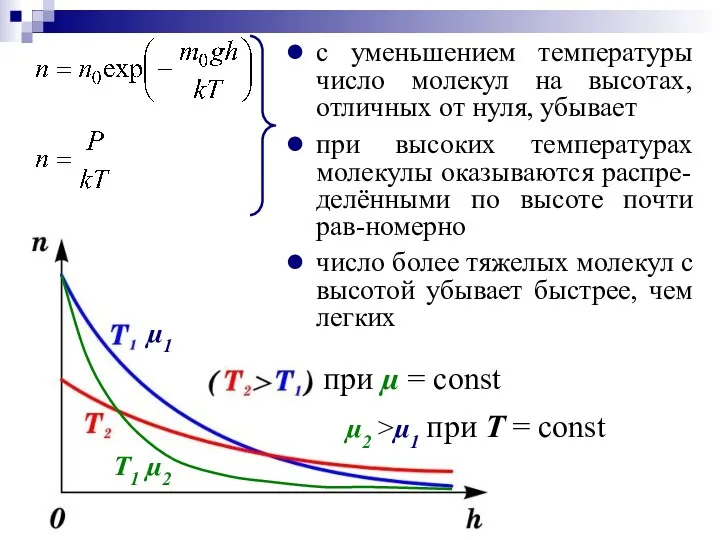
- 23. Распределение Больцмана определяет распределение частиц в силовом поле в условиях теплового равновесия. РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА P0 и
- 24. с уменьшением температуры число молекул на высотах, отличных от нуля, убывает при высоких температурах молекулы оказываются
- 25. Еп = m0gh – потенциальная энергия одной молекулы в поле тяготения на высоте h от уровня
- 26. ЯВЛЕНИЯ ПЕРЕНОСА в неравновесных системах
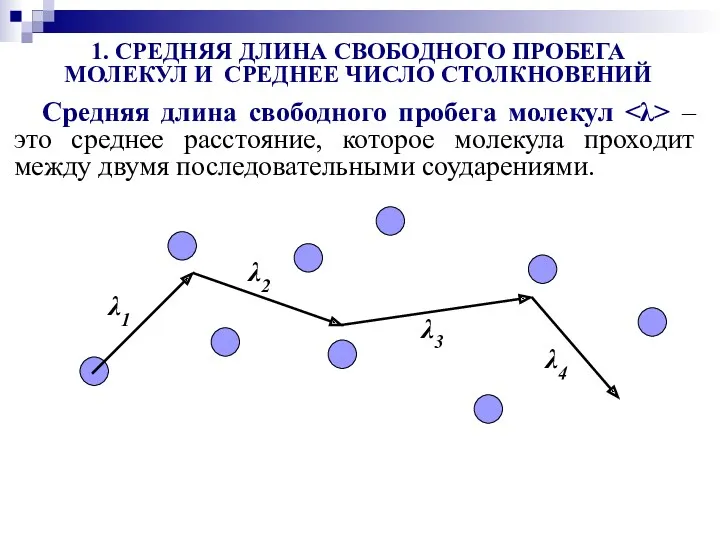
- 27. Средняя длина свободного пробега молекул – это среднее расстояние, которое молекула проходит между двумя последовательными соударениями.
- 28. Эффективный диаметр молекулы dэф – минималь-ное расстояние, на которое сближаются центры молекул при их соударении. определяется
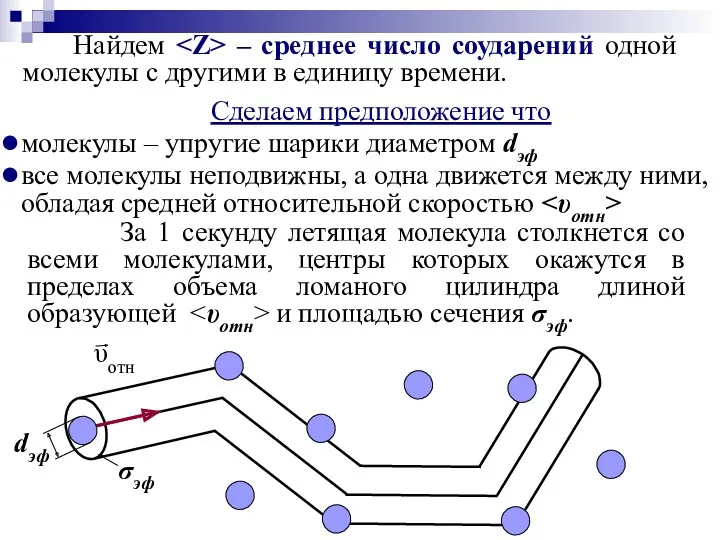
- 29. Сделаем предположение что молекулы – упругие шарики диаметром dэф все молекулы неподвижны, а одна движется между
- 30. – объем цилиндра – среднее число соударений одной молекулы с другими – средняя скорость молекулы, или
- 31. При нормальных условиях (Т = 300 К и Р = 105 Па) для газа с dэф
- 32. 1.V = const => P/T= const, но диаметр слабо уменьша-ется с ростом температуры и увеличивается. 2.
- 33. Явления переноса – круг явлений в термодинами-чески неравновесных системах, в процессе которых происходит выравнивание параметров макроскопи-ческой
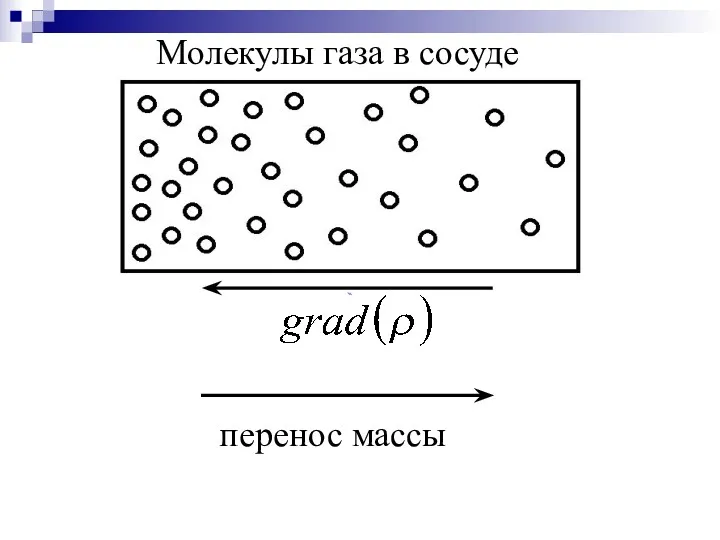
- 34. А) Диффузия – процесс переноса массы вещества молекулами за счет их хаотического движения при наличии градиента
- 35. Математически диффузия описывается законом Фика При диффузии масса переносится из мест с большей концентрацией в места
- 36. перенос массы Молекулы газа в сосуде
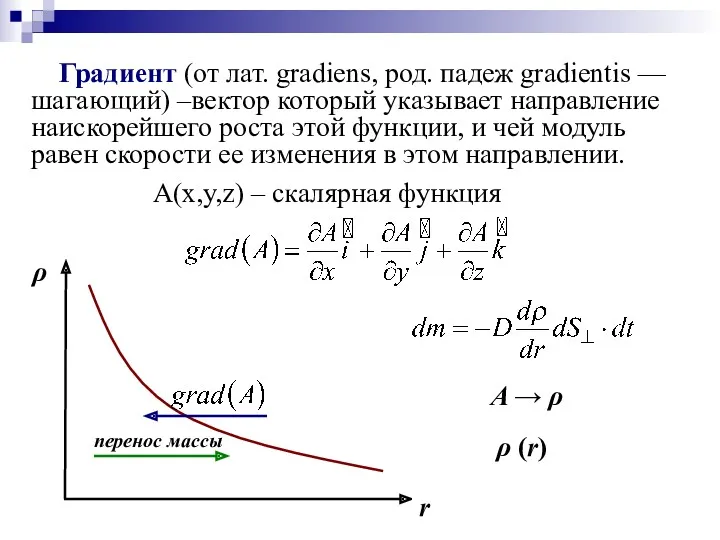
- 37. Градиент (от лат. gradiens, род. падеж gradientis — шагающий) –вектор который указывает направление наискорейшего роста этой
- 38. D – коэффициент диффузии Знак «–» показывает, что перенос массы происходит в направлении убывания плотности (обратно
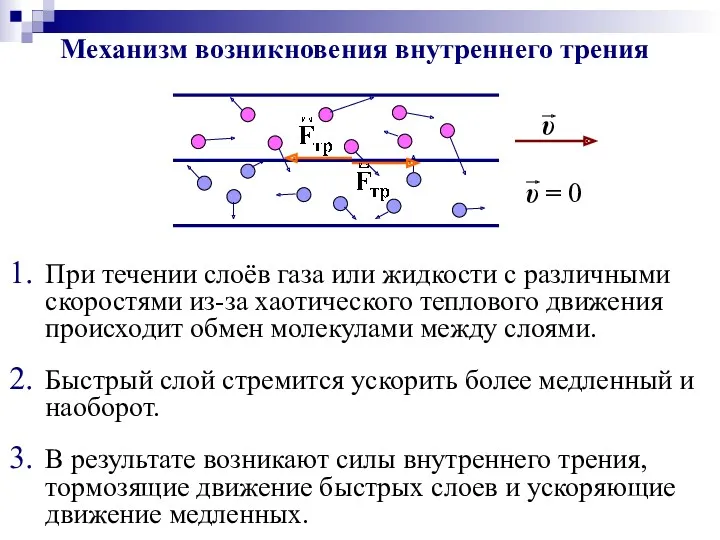
- 39. Б) Внутреннее трение (вязкость) – возникновение силы внутреннего трения при взаимодействии между слоями газа (жидкости), движущимися
- 40. Механизм возникновения внутреннего трения В результате возникают силы внутреннего трения, тормозящие движение быстрых слоев и ускоряющие
- 41. Внутреннее трение подчиняется закону Ньютона: Вязкое трение в газе (жидкости) – это результат переноса импульса направленного
- 42. – динамическая вязкость (коэффициент вязкости) ρ – плотность газа – сила терния действующая на площадку dS⊥
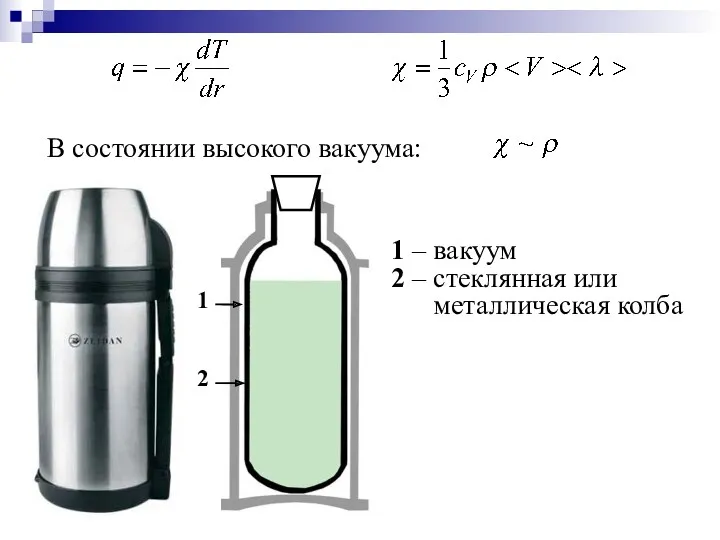
- 43. В) Теплопроводность – процесс выравнивания температуры, сопровождающийся направленным переносом тепловой энергии из более нагретых слоев в
- 44. Хаотично двигаясь, молекулы будут переходить из одного слоя газа (жидкости) в другой, перенося с собой энергию.
- 45. Процесс теплопроводности описывается законом Фурье: При теплопроводности энергия в виде тепла переносится из мест с большей
- 46. Знак «–» показывает, что при теплопроводности энергия переносится в сторону убывания температуры. – тепло переносимое через
- 47. Коэффициент теплопроводности численно равен количеству теплоты, переносимому через единичную площадку в единицу времени при температурном градиенте,
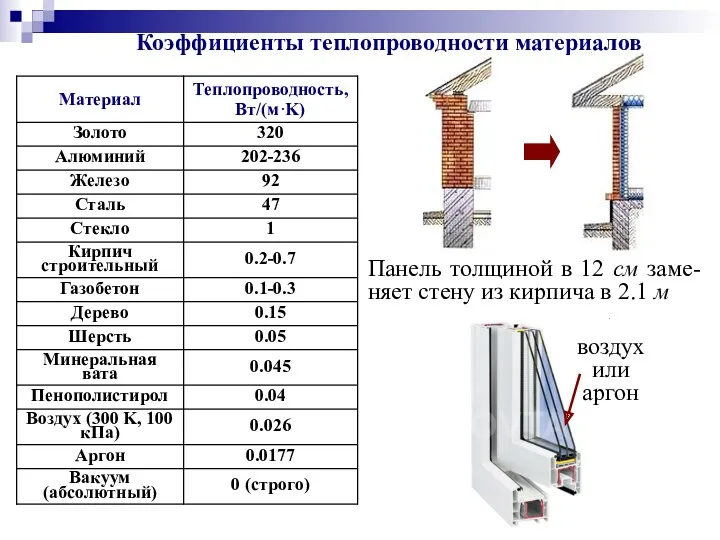
- 48. воздух или аргон Коэффициенты теплопроводности материалов Панель толщиной в 12 см заме-няет стену из кирпича в
- 50. Скачать презентацию































 Зануление
Зануление Тормозная система КамАЗа
Тормозная система КамАЗа Модели простых сплошных сред
Модели простых сплошных сред Электрические цепи переменного тока. Лекция 2
Электрические цепи переменного тока. Лекция 2 Характеристики спектров кристаллов
Характеристики спектров кристаллов Виды топлива
Виды топлива Development of a high performance optical cesium beam clock for ground applications
Development of a high performance optical cesium beam clock for ground applications Система энергоснабжения и электрического пуска двигателя. Тема 21
Система энергоснабжения и электрического пуска двигателя. Тема 21 Атмосферное давление. Интегрированный урок
Атмосферное давление. Интегрированный урок Сила упругости
Сила упругости Сила. Графічне зображення сил
Сила. Графічне зображення сил Основы молекулярной и статистической физики
Основы молекулярной и статистической физики Тоқ көздері. Бөгде күштер
Тоқ көздері. Бөгде күштер Плавание тел
Плавание тел Ядерные реакторы
Ядерные реакторы Электрические цепи постоянного тока. (Лекция 1)
Электрические цепи постоянного тока. (Лекция 1) Теория электрических цепей
Теория электрических цепей Енераторларға техникалық қызмет көрсету және жөндеу
Енераторларға техникалық қызмет көрсету және жөндеу Свойства и строение жидкости
Свойства и строение жидкости Теплообменные процессы
Теплообменные процессы Bases of endoscopic surgery
Bases of endoscopic surgery 20181129_elektricheskoe_soprotivlenie.udelnoe_soprotivlenie
20181129_elektricheskoe_soprotivlenie.udelnoe_soprotivlenie Механика. Введение. Кинематика
Механика. Введение. Кинематика Энтропия. Второе начало термодинамики
Энтропия. Второе начало термодинамики Взаимодействие света с веществом. Лекция №8
Взаимодействие света с веществом. Лекция №8 Электрический ток
Электрический ток Физика горных пород. Жидкости и газы в горных породах
Физика горных пород. Жидкости и газы в горных породах Сила. Явление тяготения. Сила тяжести
Сила. Явление тяготения. Сила тяжести