Содержание
- 2. Электрохимические методы анализа
- 3. Электрохимические методы анализа занимают достойное место среди методов контроля состояния окружающей среды, так как способны обеспечить
- 4. Электрохимические методы классифицируют следующим образом: Методы без наложения внешнего потенциала (равновесные методы), основанные на измерении разности
- 6. Потенциометрические методы анализа Потенциометрия относится к равновесным методам электрохимического анализа. В основе потенциометрических измерений лежит зависимость
- 7. В потенциометрии замеряют электродвижущие силы (ЭДС). При потенциометрических измерениях в электрохимической ячейке используют два электрода: рабочий
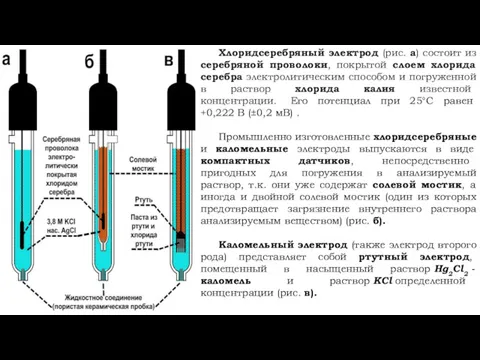
- 8. Хлоридсеребряный электрод (рис. а) состоит из серебряной проволоки, покрытой слоем хлорида серебра электролитическим способом и погруженной
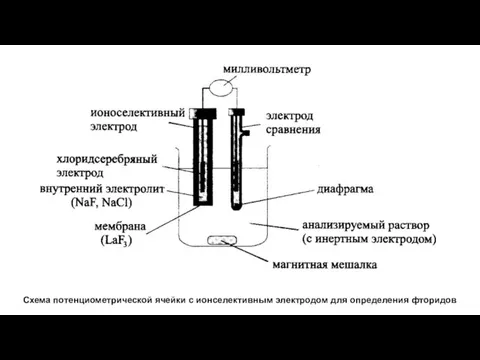
- 9. Схема потенциометрической ячейки с ионселективным электродом для определения фторидов
- 10. Различают прямую потенциометрию (ионометрию, рН-метрию, редоксметрию) и потенциометрическое титрование. В прямой потенциометрии непосредственно проводят измерения потенциала
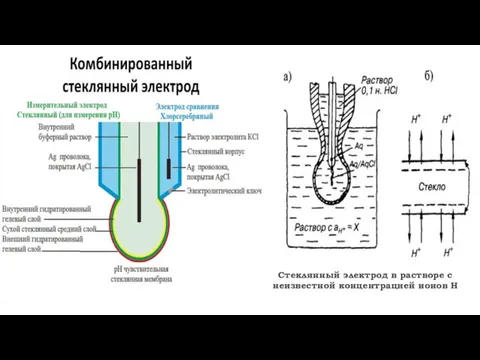
- 11. Стеклянный электрод в растворе с неизвестной концентрацией ионов Н
- 12. В редоксметрии применяют окислительно-восстановительные электроды из благородных металлов (Pt, Au, Pd и др.). Данные электроды являются
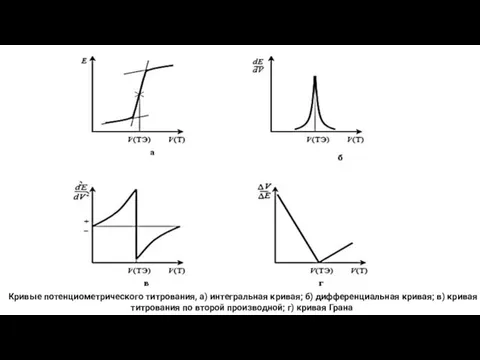
- 13. Кривые потенциометрического титрования, а) интегральная кривая; б) дифференциальная кривая; в) кривая титрования по второй производной; г)
- 14. Показатели в объектах окружающей среды, определяемые потенциометрией с применением различных электродов
- 15. Приборы, основанные на потенциометрических методах анализа Ионометрия (pН-метр Эксперт-рН) Редоксметрия (Портативный измеритель ОВП (редокс-метр) Starter ST10R)
- 16. Вольтамперометрические методы анализа Вольтамперометрические методы относятся к неравновесным электрохимическим методам, в которых контролируемый параметр — потенциал
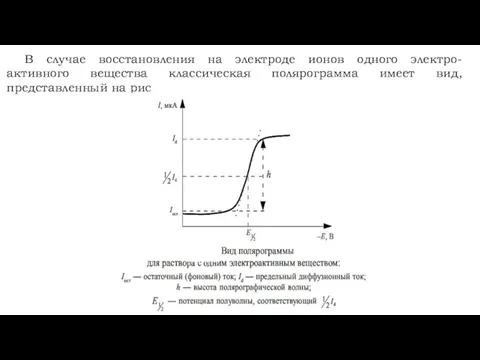
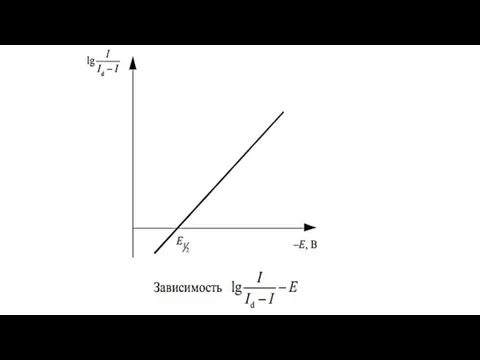
- 17. В случае восстановления на электроде ионов одного электро- активного вещества классическая полярограмма имеет вид, представленный на
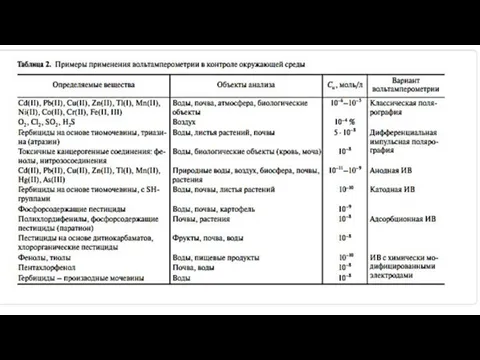
- 21. В вольтамперометрии (ВА) в качестве рабочих электродов используют стационарные металлические, углеродсодержащие, пленочные и другие электроды (кроме
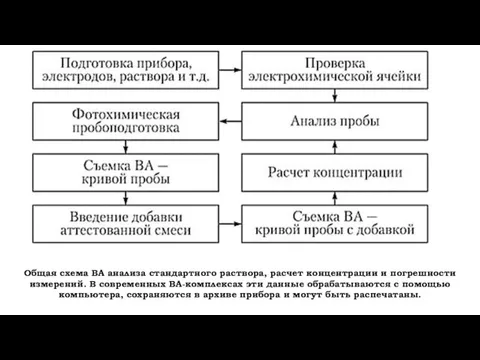
- 22. Общая схема ВА анализа стандартного раствора, расчет концентрации и погрешности измерений. В современных BA-комплексах эти данные
- 24. Приборы для вольтамперометрического анализа Вольтамперометрический анализатор ТА-Lab Комплекс аналитический вольтамперометрический СТА
- 25. Методы кулонометрического анализа Методы кулонометрии основаны на измерении количества электричества, затраченного на электролиз. Электролиз — химическое
- 26. Количество электричества (Q, Кл) и масса вещества (m, г), подвергшегося электролизу, связаны объединенным законом Фарадея: где
- 27. Классификация кулонометрических методов анализа Прямая Косвенная (кулонометрическое титрование)
- 28. Приборы для кулонометрического анализа Титратор Фишера кулонометрический ПЭ-9210 Кулонометр WTK
- 30. Скачать презентацию



















 Записать формулы
Записать формулы Как и где используется соляная кислота
Как и где используется соляная кислота Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Решение заданий ЕГЭ на составление окислительно-восстановительных реакций
Решение заданий ЕГЭ на составление окислительно-восстановительных реакций Electron Structure
Electron Structure Состав веществ. Причины многообразия веществ
Состав веществ. Причины многообразия веществ Природные источники углеводородов
Природные источники углеводородов Соли. Определение солей
Соли. Определение солей Классы неорганических соединений
Классы неорганических соединений Гидролиз солей
Гидролиз солей Хімічні властивості кислот
Хімічні властивості кислот Общая характеристика неметаллов
Общая характеристика неметаллов р-элементы V группы (пниктогены) N, P, As, Sb, Bi
р-элементы V группы (пниктогены) N, P, As, Sb, Bi Карбонильные соединения
Карбонильные соединения Определение витамина “С” в продуктах питания с помощью иодометрии
Определение витамина “С” в продуктах питания с помощью иодометрии Метаморфогенные месторождения
Метаморфогенные месторождения Аммиак. Состав вещества
Аммиак. Состав вещества Химическая связь
Химическая связь Оксид углерода-С
Оксид углерода-С Каменный уголь
Каменный уголь Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Химия и проблемы охраны окружающей среды
Химия и проблемы охраны окружающей среды Коррозия металлов
Коррозия металлов Изотопы. История открытия. Изотопы водорода
Изотопы. История открытия. Изотопы водорода Современные тенденции развития химии
Современные тенденции развития химии Наука о веществе - химия
Наука о веществе - химия Неорганическая химия
Неорганическая химия