Слайд 2

Нахождение в природе
Среди других элементов занимает 23 – е место. Природный
элемент цинк – это смесь 5 стабильных изотопов. С массовыми числами 64, 66, 67, 68 и 70. Наиболее распространен 64 Zn.
Важнейший минерал цинка – сфалерит (или цинковая обманка) – ZnS.
ZnO – цинкит;
ZnCO3 – смитсонит;
ZnO ∙ Al2O3 – шпинель.
Слайд 3

Физические свойства
Цинк – металл синевато – белого цвета средней твердости. Плотность
7,13 г/см3. Легко плавится (t пл. = 419,50С) и принадлежит к числу наиболее летучих металлов (tкип. =9060С). Цинк высокой чистоты пластичен, т.е. его можно ковать и прокатывать в тонкую фольгу. На воздухе его поверхность покрывается оксидной пленкой и тускнеет.
Слайд 4

Химические свойства
Цинк Zn – химически активен, обладает хорошо выраженными восстановительными свойствами.
При достаточном нагревании на воздухе цинк сгорает ярким голубоватым пламенем, образуя оксид цинка ZnO:
2Zn +O2 = 2ZnO В соединениях цинк постоянно проявляет степень окисления +2.
Взаимодействие с другими неметаллами:
Zn + S = ZnS
Zn + Br2 =ZnBr2 ; Zn + Cl2 = ZnCl2
3Zn + 2P =Zn3P2
Zn + H2 = ZnH2
Слайд 5
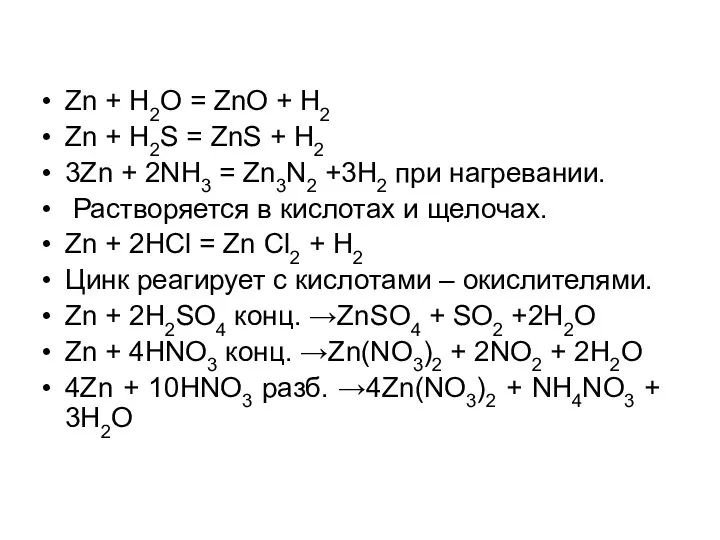
Zn + H2O = ZnO + H2
Zn + H2S = ZnS
+ H2
3Zn + 2NH3 = Zn3N2 +3H2 при нагревании.
Растворяется в кислотах и щелочах.
Zn + 2HCl = Zn Cl2 + H2
Цинк реагирует с кислотами – окислителями.
Zn + 2H2SO4 конц. →ZnSO4 + SO2 +2H2O
Zn + 4HNO3 конц. →Zn(NO3)2 + 2NO2 + 2H2O
4Zn + 10HNO3 разб. →4Zn(NO3)2 + NH4NO3 + 3H2O
Слайд 6
![C растворами щелочей. Zn + 2NaOH + 2H2O = Na2[Zn(OH)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/351176/slide-5.jpg)
C растворами щелочей.
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Zn
+ 4NH4OH= [Zn(NH3)4](OH)2 + H2 +2H2O
Zn + CuSO4 = ZnSO4 + Cu
Применение: для покрытия металлических изделии (защита от коррозии), в состав сплавов- латунь, нейзильбер.
Слайд 7

Получение
1. Обжигом цинковой руды.
2ZnS + 3O2= 2ZnO + 2SO2
От ZnO к
Zn идут двумя путями:
1. Пирометаллургией:
ZnO + C = Zn + CO
2. Гидрометаллугией:
ZnO растворяют в серной кислоте, полученный соль подвергают электролизу (цинк осаждается на катоде).
Слайд 8

Оксид цинка - ZnO
ZnO – амфотерный оксид, порошок белого цвета, тугоплавкий
t пл. =20000С. С водой не реагирует, растворяется в кислотах и щелочах, образуя соли – цинкаты.
ZnO + CaO = CaZnO2
ZnO + SiO2 = ZnSiO3
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
ZnO + C = Zn + CO
Применяется в косметике и в медицине (мази, пасты, присыпки при кожных заболеваниях).
Слайд 9

Гидроксид цинка
Zn(OH)2 – вещество амфотерное, нерастворимое в воде, но хорошо растворимое
в кислотах и щелочах.
Zn Cl2 + 2NaOH = Zn(OH)2 + 2NaCl
Zn(OH)2 + 2HCl= Zn Cl2 + 2H2O
Zn(OH)2 + 2NaOH =Na2[Zn(OH)4]
Zn(OH)2 + 4NH4OH= [Zn(NH3)4](OH)2 + 4H2O
Слайд 10

Cоли цинка
Из солей цинка важнейшими являются
ZnCl2, ZnSO4, ZnS. Cпособны к
образованию комплексных соединений.
2KCN + Zn(CN)2 = K2[Zn(CN)4]
ZnCl2 + 4NaOH =Na2[Zn(OH)4] + 2NaCl
ZnCl2 + AgNO3 = Zn(NO3)2 +2 AgCl↓
ZnSO4 ∙ 7H2O – цинковый купорос, лекарственное средство.
ZnCl2 – травленная кислота применяется при паянии, для пропитки древесины с целью предохранения от гниении.
ZnS – входит в состав белой краски. Получают следующей реакцией:
ZnSO4 + BaS = BaSO4↓ + ZnS
Слайд 11

Серебро
Серебро – тяжелый, пластичный металл с характерным металлическим блеском. Тпл. =
9620С. Обладает наибольшей электро- и теплопроводностью, образует сплавы со многими металлами.
Встречается в виде Ag2S – серебряный блеск, в виде тиосолей Ag3SbS3 – тиоантимонита серебра
Слайд 12

Химические свойства
Является малоактивным благородным металлом. Непосредственно не взаимодействует с кислородом. Не
реагирует с разбавленными растворами HCl, H2SO4, но реагирует с концентрированнми кислотами.
Не окисляется кислородом воздуха, сохраняет металлический блеск.
Поверхность серебра чернеет на воздухе из – за взаимодействия с сероводородом:
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
Слайд 13

Ag + S = Ag2S
2Ag + Cl2 = 2AgCl
2Ag + SO2
+ O2 = Ag2SO4
Ag + O3 = Ag2O + O2
2Ag + H2S = Ag2S + H2
2Ag + 2HI = 2AgI + H2
2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2O
Ag + 2HNO3 = AgNO3 +NO2 + H2O
Серебро в малых количествах растворяется в воде, но даже в таких количествах ионы серебра «убивают» микроорганизмы.
Слайд 14

Ag2O – твердое вещество, темно – коричневого цвета, разлагается при нагревании,
проявляет основные свойства, плохо растворяется в HCl, H2SO4, но хорошо растворяется в HNO3 и в растворе NH3.
2AgNO3 + 2KOH = 2KNO3 + Ag2O + H2O
Слайд 15
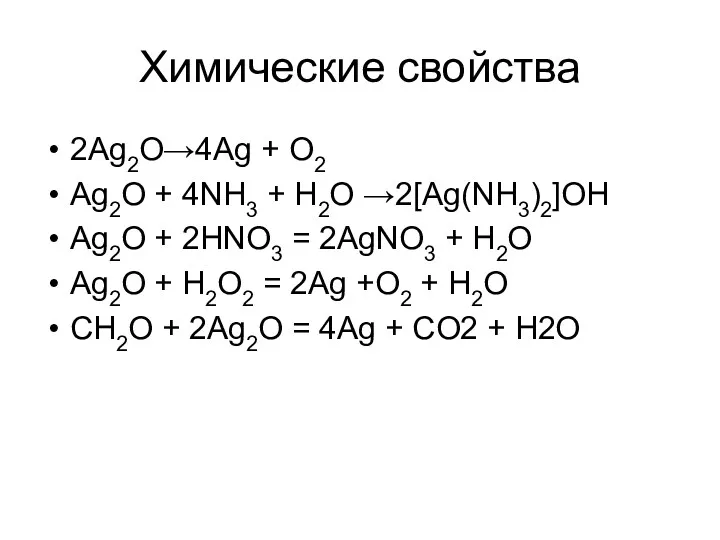
Химические свойства
2Ag2O→4Ag + O2
Ag2O + 4NH3 + H2O →2[Ag(NH3)2]OH
Ag2O + 2HNO3
= 2AgNO3 + H2O
Ag2O + H2O2 = 2Ag +O2 + H2O
CH2O + 2Ag2O = 4Ag + CO2 + H2O




![C растворами щелочей. Zn + 2NaOH + 2H2O = Na2[Zn(OH)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/351176/slide-5.jpg)









 Кремний в природе. Использование кремнезема для производства стекла. 9 класс
Кремний в природе. Использование кремнезема для производства стекла. 9 класс Применение алканов
Применение алканов Растворы. Свойства растворов. (Тема 3)
Растворы. Свойства растворов. (Тема 3) Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии
Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии Общая характеристика липидов. Строение. Классификация. Функции. Переваривание и всасывание липидов в ЖКТ Роль желчи
Общая характеристика липидов. Строение. Классификация. Функции. Переваривание и всасывание липидов в ЖКТ Роль желчи Углерод. Общая характеристика элементов подгруппы углерода
Углерод. Общая характеристика элементов подгруппы углерода Серная кислота и ее соли
Серная кислота и ее соли Алюминий туралы мәлімет
Алюминий туралы мәлімет Химиялық термодинамиканың негізгі түсініктерінің биохимияда қолданылуы
Химиялық термодинамиканың негізгі түсініктерінің биохимияда қолданылуы Топливный элемент
Топливный элемент Химическая кинетика
Химическая кинетика Химия. Дисперсные системы. Растворы
Химия. Дисперсные системы. Растворы Химия нефти и газа
Химия нефти и газа Морские льды. Их классификация и закономерности движения
Морские льды. Их классификация и закономерности движения Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно
Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно Материаловедение. Лекция 1
Материаловедение. Лекция 1 Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Строение и свойства атомов в свете квантовомеханической теории. Периодический закон – основа основ химии
Строение и свойства атомов в свете квантовомеханической теории. Периодический закон – основа основ химии Цинк. Месторождения. Применение
Цинк. Месторождения. Применение Классификация неорганических веществ. Оксиды
Классификация неорганических веществ. Оксиды Основное уравнение молекулярно-кинетической теории. Идеальный газ
Основное уравнение молекулярно-кинетической теории. Идеальный газ Галогены. Элементы VII группы
Галогены. Элементы VII группы Витаминные препараты
Витаминные препараты Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау
Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау Равновесия в растворах электролитов
Равновесия в растворах электролитов 150 лет теории строения органических соединений
150 лет теории строения органических соединений Амінокислоти. Склад і будова молекул, загальні та структурні формули, систематична номенклатура
Амінокислоти. Склад і будова молекул, загальні та структурні формули, систематична номенклатура Строение и свойства металлов. Физические и механические свойства металлов
Строение и свойства металлов. Физические и механические свойства металлов