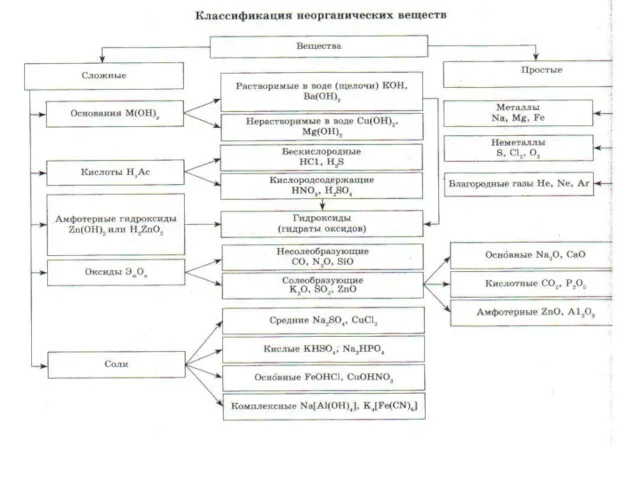
Содержание
- 3. ОКСИДЫ Смотрите в папках данную тему! Оксиды- бинарные соединения с кислородом в степени окисления (-2). Общая
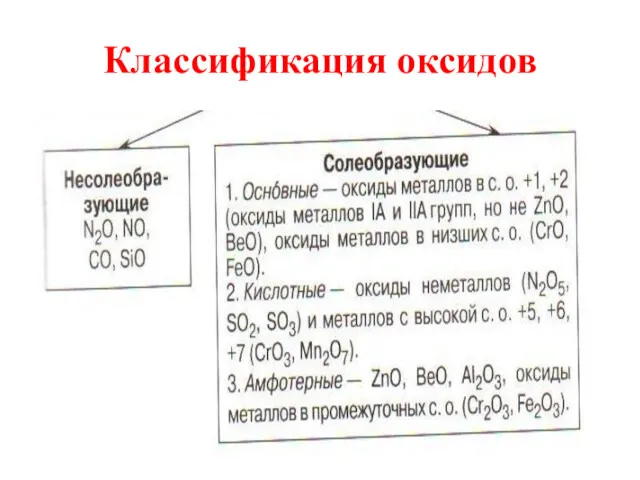
- 4. Классификация оксидов
- 5. Несолеобразующие оксиды Несолеебразующими называются такие оксиды, которые не взаимодействуют ни со щелочами, ни с кислотами и
- 6. Солеобразующие Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль
- 7. Основные оксиды Основные оксиды - это такие оксиды, которым соответствуют основания. Например: СаО - Са(ОН)2 Na2O
- 8. Кислотные оксиды Кислотные оксиды - это такие оксиды, которым соответствуют кислоты. Это оксиды неметаллов: N2O 5
- 9. Амфотерные оксиды Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Это
- 10. По какому признаку солеобразующие оксиды делят на три вида? Осуществите данные превращения! Основной оксид— основание--- соль
- 11. Тест №1 1. Среди следующих формул оксидом является: 1) НСl 2) Na2SO4 3) Na2O 4) NaOH.
- 12. Тест № 2 1. С серной кислотой будет взаимодействовать: 1) SO3 2) Mn2O7 3) N2O5 4)
- 13. Тест № 3 1. С гидроксидом натрия будет реагировать: 1) СаО 2) СО 3) SO3 4)
- 14. Тест № 4 1. Коэффициент перед формулой кислорода в уравнении реакции, схема которой Аl + O2
- 15. Задание. 1) Из следующего перечня выписать отдельно химические формулы оксидов, оснований, кислот, солей: 2) С какими
- 17. Скачать презентацию












 Химические аспекты метаболизма лекарственных препаратов
Химические аспекты метаболизма лекарственных препаратов Драгоценные камни
Драгоценные камни Щелочной металл натрий
Щелочной металл натрий Степень окисления – Условный заряд атомов химического элемента в соединении
Степень окисления – Условный заряд атомов химического элемента в соединении Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Альдегіди. Номенклатура альдегідів
Альдегіди. Номенклатура альдегідів Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел БАЗ-ды алу. БАЗ өндірудегі шикізат базасы. 2 Лекция
БАЗ-ды алу. БАЗ өндірудегі шикізат базасы. 2 Лекция Общая геохимия. Атомная и молекулярная масса. Представление результатов аналитических исследований
Общая геохимия. Атомная и молекулярная масса. Представление результатов аналитических исследований Строение атома. 8 класс
Строение атома. 8 класс Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины
Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины Вуглеводи. Загальна характеристика вуглеводів, представники
Вуглеводи. Загальна характеристика вуглеводів, представники Азотная кислота и её соли
Азотная кислота и её соли Закон действующих масс и его применение в аналитической химии
Закон действующих масс и его применение в аналитической химии Валентність хімічних елементів
Валентність хімічних елементів Классы неорганических веществ
Классы неорганических веществ Изотопы, их свойства и применение
Изотопы, их свойства и применение Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Липиды растений и их обмен
Липиды растений и их обмен Процессы и аппараты химических производств
Процессы и аппараты химических производств Полибутадиен
Полибутадиен Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Геохимия литосферы
Геохимия литосферы Основания. Получение и химические свойства
Основания. Получение и химические свойства Базовое нефтехимическое сырье
Базовое нефтехимическое сырье Химическая связь
Химическая связь Природные источники углеводородов
Природные источники углеводородов