Содержание
- 2. «Расчлените каждую изучаемую вами задачу на столько частей, на сколько сможете и на сколько это потребуется
- 3. Речь о задачах, решение которых связано с понятиями «концентрация» и «процентное содержание». В условиях речь идет
- 4. Цель работы: -- получить расширенную информацию о задачах на смеси и их применении, в расчетах при
- 5. Основные понятия в задачах на смеси, растворы и сплавы
- 6. «Смесь» «Чистое вещество» «Примесь» Доли чистого вещества в смеси – «a» Чистое вещество – «m» Общее
- 7. Понятие доли чистого вещества в смеси можно вводить следующей условной записью: Доля чистого вещества в смеси
- 8. Отметим, что 0 ≤ a ≤ 1, ввиду того, что 0 ≤ m ≤ M. a=0
- 9. Процентное содержание чистого вещества в смеси w w = a ·100%, a = w :100%
- 10. При решении задач о смесях, сплавах и растворах используются следующие допущения: Всегда выполняется «Закон сохранения объема
- 11. Выбор неизвестной (или неизвестных). Выбор чистого вещества. Переход к долям. Отслеживание состояния смеси. Составление уравнения. Решение
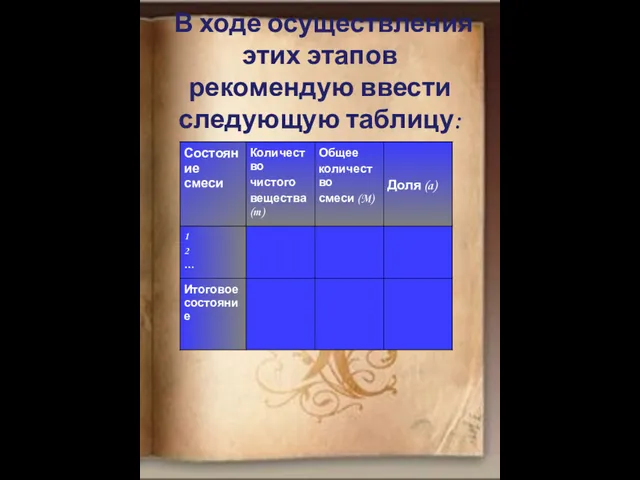
- 12. В ходе осуществления этих этапов рекомендую ввести следующую таблицу:
- 13. Основными методами решения задач на смешивание растворов являются: С помощью расчетной формулы Правило смешения Графический метод
- 14. С помощью расчетной формулы Масса полученного при смешивании раствора равна mр-ра = m1р-ра + m2р-ра Массы
- 15. Правило смешения Воспользуемся формулой: ω = (m1 · ω1 + m2 · ω2) / (m1 +
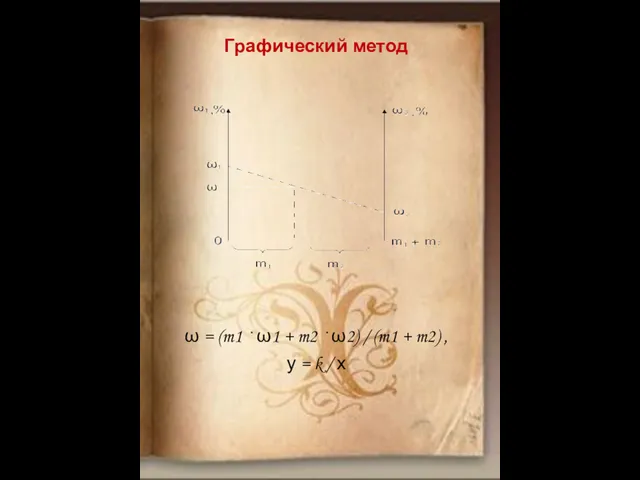
- 16. Графический метод ω = (m1 · ω1 + m2 · ω2) / (m1 + m2) ,
- 17. Алгебраический метод Задачи на смешивание растворов решают также с помощью составления уравнения или системы уравнений.
- 18. Задача. (ЕГЭ) В 100 г 20% раствора соли добавили 300 г её 10% раствора. Определите процентную
- 19. Алгебраический. Пусть х – процентная концентрация полученного раствора. В первом растворе содержится 0,2 · 100(г) соли,
- 20. Старинный способ решения задач на смеси ( правило креста) Пример В каких пропорциях нужно смешать раствор
- 21. В этой схеме слева записана с - требуемая концентрация кислоты в процентах, затем друг под другом
- 22. Задача. В каких пропорциях нужно смешать раствор 50-процентной и раствор 70-процентной кислоты, чтобы получить раствор 65-процентной
- 24. Задача Имеет некто чай 3х сортов – цейлонский по 5 гривен за фунт, индийский по 8
- 25. Квадрат Пирсона (диагональная схема)
- 28. Скачать презентацию























 Текстові задачі. Розв'язування задач за допомогою рівнянь
Текстові задачі. Розв'язування задач за допомогою рівнянь Способи обчислення границь
Способи обчислення границь Арифметический квадратный корень. Урок – КВН
Арифметический квадратный корень. Урок – КВН Урок 10. Случайные величины. Дискретные и непрерывные случайные величины (ДСВ и НСВ)
Урок 10. Случайные величины. Дискретные и непрерывные случайные величины (ДСВ и НСВ) Предварительный анализ данных. Описательные статистики
Предварительный анализ данных. Описательные статистики Общие методы решения тригонометрических уравнений
Общие методы решения тригонометрических уравнений интерактивный тренажёр Вычитание в пределах 20
интерактивный тренажёр Вычитание в пределах 20 Умножение и деление на 4
Умножение и деление на 4 Бесконечно убывающая геометрическая прогрессия. 10 класс
Бесконечно убывающая геометрическая прогрессия. 10 класс Симметрия на плоскости
Симметрия на плоскости Благоприятствующие элементарные события. Вероятность событий
Благоприятствующие элементарные события. Вероятность событий Модуль и его приложения
Модуль и его приложения Презентация к занятию Путешествие в сказку
Презентация к занятию Путешествие в сказку Площадь трапеции. Свойства площадей
Площадь трапеции. Свойства площадей Зеркальное отражение. Симметрия (1 класс)
Зеркальное отражение. Симметрия (1 класс) Квадратные уравнения
Квадратные уравнения Перпендикулярні прямі
Перпендикулярні прямі Системы двух линейных уравнений с двумя переменными
Системы двух линейных уравнений с двумя переменными Презентация к уроку математики Число и цифра 8
Презентация к уроку математики Число и цифра 8 Первый замечательный предел
Первый замечательный предел Внеклассное занятие по математике. Тема:Время
Внеклассное занятие по математике. Тема:Время Презентация к уроку математики Решение задач с помощью уравнения
Презентация к уроку математики Решение задач с помощью уравнения Задачи межпредметного смысла на уроке математики
Задачи межпредметного смысла на уроке математики Использование информационных технологий в экономических моделях
Использование информационных технологий в экономических моделях Блок уроков по геометрии. Вписанный четырехугольник. Подготовка к ОГЭ. 9 класс
Блок уроков по геометрии. Вписанный четырехугольник. Подготовка к ОГЭ. 9 класс Последовательности и прогрессии в жизни
Последовательности и прогрессии в жизни Десятичная запись дробных чисел
Десятичная запись дробных чисел Cложение и вычитание чисел с разными знаками. Обобщающий урок. 6 класс
Cложение и вычитание чисел с разными знаками. Обобщающий урок. 6 класс