Химические и физико-химические методы стандартизации и контроля качества лекарственных. (Лекция 3) презентация
Содержание
- 2. Растворимость
- 3. Методы определения температуры плавления (ГФУ) Капиллярный метод Открытый капиллярный метод Метод мгновенного плавления Метод каплепадения Инструментальный
- 4. Прибор для определения температуры кипения
- 5. Рефрактометрическое определение концентрации растворов где: X — концентрация раствора; n — показатель преломления раствора; n0— показатель
- 6. Удельное оптическое вращение рассчитывают по формулам: для жидкостей: для веществ в растворе:
- 7. Кислотное число где: n – количество 0,1 М раствора калия гидроксида, израсходованное на титрование, в миллилитрах
- 8. Эфирное число где: IS – число омыления; IA – кислотное число. где: n2 и n1 –
- 9. Гидроксильное число. Метод А где: n2 и n1 – объемы 0,5 М раствора KOH, израсходованного на
- 10. Гидроксильное число. Метод Б где: n2 и n1 – объемы 0,1 М раствора кислоты хлорной, израсходованного
- 11. Перекисное число. Метод А где: n2 и n1 – объемы 0,01 М раствора натрия тиосульфата, израсходованного
- 12. Перекисное число. Метод Б где: V2 и V0 – объемы раствора натрия тиосульфата, израсходованного на титрование
- 13. Число омыления где: n2 и n1 – объемы 0,5 М раствора кислоты хлористоводородной, израсходованного на титрование
- 14. Водородный показатель (рН) Водородный показатель (рН) является количественной характеристикой кислотности среды. Он равен отрицательному десятичному логарифму
- 16. Скачать презентацию













 Генетика олигофрений. Группа хромосомных заболеваний
Генетика олигофрений. Группа хромосомных заболеваний Телемедицина. Возможности и перспективы
Телемедицина. Возможности и перспективы 2011-2015 жылдарға Саламатты Қазақстан Қазақстан Республикасы денсаулық сақтау саласын дамытудың мемлекеттік бағдарламасы
2011-2015 жылдарға Саламатты Қазақстан Қазақстан Республикасы денсаулық сақтау саласын дамытудың мемлекеттік бағдарламасы Акне. Иммунная система кожи
Акне. Иммунная система кожи Основы урологии
Основы урологии Hormones and the Endocrine System
Hormones and the Endocrine System Мигрень. Диагностика. Лечение. Профилактика
Мигрень. Диагностика. Лечение. Профилактика Клинические особенности менингококковой инфекции у детей на современном этапе
Клинические особенности менингококковой инфекции у детей на современном этапе Аденовирусные инфекции. Грипп
Аденовирусные инфекции. Грипп Дезинфекция медицинских изделий
Дезинфекция медицинских изделий Вторичные соматические симптомы при поражении нервной системы
Вторичные соматические симптомы при поражении нервной системы Сүйек тінінің жасқа байланысты ерекшеліктері
Сүйек тінінің жасқа байланысты ерекшеліктері Основні переваги грудного вигодовування малят
Основні переваги грудного вигодовування малят Obsessive-Compulsive Disorder
Obsessive-Compulsive Disorder Лекарственные растения и сырье, содержащие жиры и жироподобные вещества. (Лекция 6)
Лекарственные растения и сырье, содержащие жиры и жироподобные вещества. (Лекция 6) Ауыз қуысының микоздары. Ашытқы тәріздес кандида саңырауқұлақтары. Қасиетері, адам патологиясындағы рөлі
Ауыз қуысының микоздары. Ашытқы тәріздес кандида саңырауқұлақтары. Қасиетері, адам патологиясындағы рөлі Какие заболевания называются облигатно-трансмиссивными? Медицинская протозоология
Какие заболевания называются облигатно-трансмиссивными? Медицинская протозоология Пневмонии и рак легких
Пневмонии и рак легких Лор ағзалардың құрылымы мен топографиясының жасқа байланысты ерекшеліктері.Лор ағзалардың патологиясындағы маңызы
Лор ағзалардың құрылымы мен топографиясының жасқа байланысты ерекшеліктері.Лор ағзалардың патологиясындағы маңызы Вирусные гепатиты: лечение и профилактика
Вирусные гепатиты: лечение и профилактика Сіреспеге қарсы қолданылатың дәрілік заттарға сипаттама
Сіреспеге қарсы қолданылатың дәрілік заттарға сипаттама Анализ заболеваемости острыми кишечными инфекциями, вызванные неустановленными инфекционными возбудителями населения
Анализ заболеваемости острыми кишечными инфекциями, вызванные неустановленными инфекционными возбудителями населения День донорства
День донорства Бүйрек және зәр биохимиясы
Бүйрек және зәр биохимиясы Сибирская язва
Сибирская язва Әртүрлі иондаушы сәулелер көздері түрлерінің заттармен өзара әсерлесуі. (Тақырып 2)
Әртүрлі иондаушы сәулелер көздері түрлерінің заттармен өзара әсерлесуі. (Тақырып 2)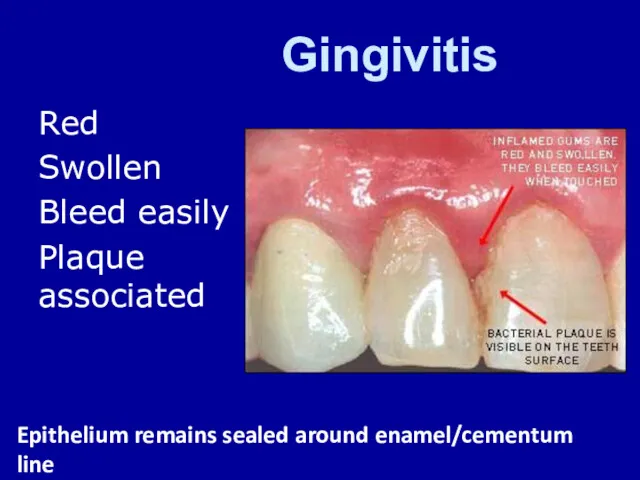 Periodontal Disease
Periodontal Disease Ортодонтические изгибы, их виды и техника нанесения на ортодонтические дуги
Ортодонтические изгибы, их виды и техника нанесения на ортодонтические дуги