Содержание
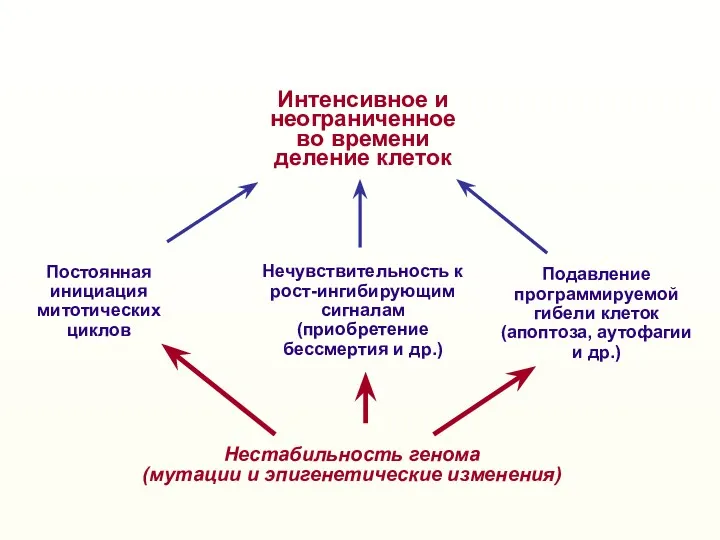
- 2. Нестабильность генома (мутации и эпигенетические изменения) Нечувствительность к рост-ингибирующим сигналам (приобретение бессмертия и др.) Постоянная инициация
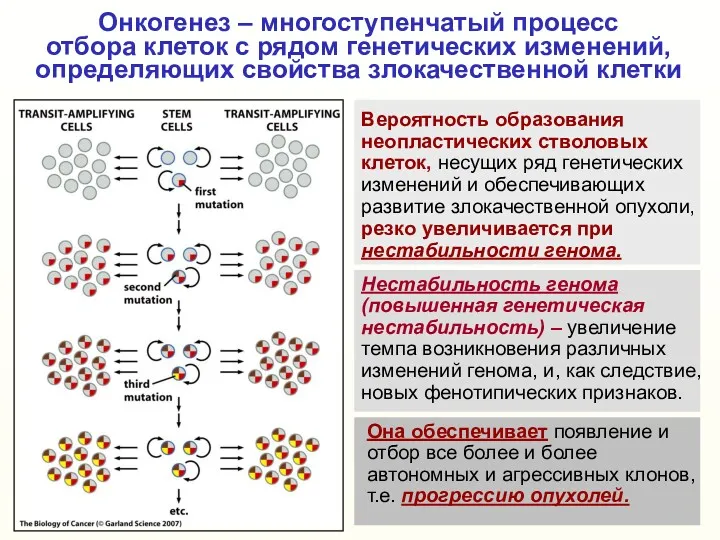
- 3. Онкогенез – многоступенчатый процесс отбора клеток с рядом генетических изменений, определяющих свойства злокачественной клетки
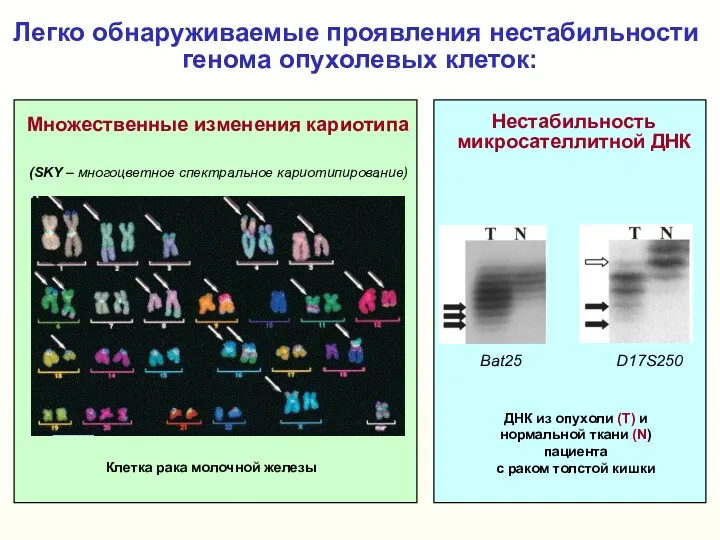
- 4. Легко обнаруживаемые проявления нестабильности генома опухолевых клеток: (SKY – многоцветное спектральное кариотипирование) Множественные изменения кариотипа Bat25
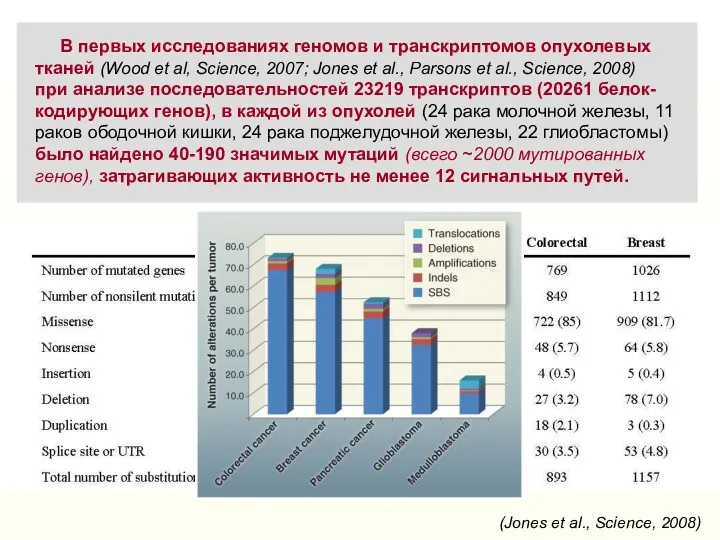
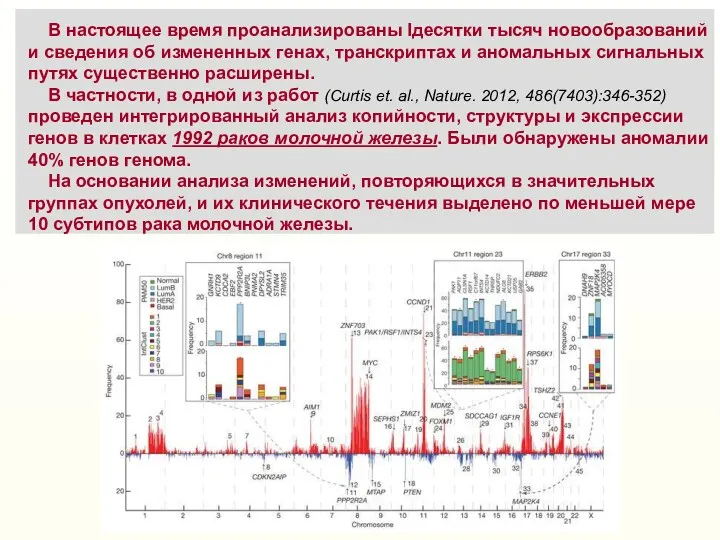
- 5. В первых исследованиях геномов и транскриптомов опухолевых тканей (Wood еt al, Science, 2007; Jones et al.,
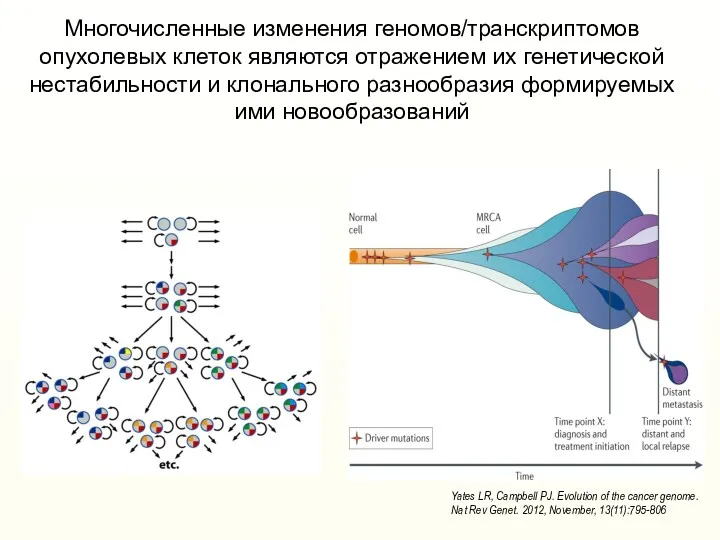
- 7. Многочисленные изменения геномов/транскриптомов опухолевых клеток являются отражением их генетической нестабильности и клонального разнообразия формируемых ими новообразований
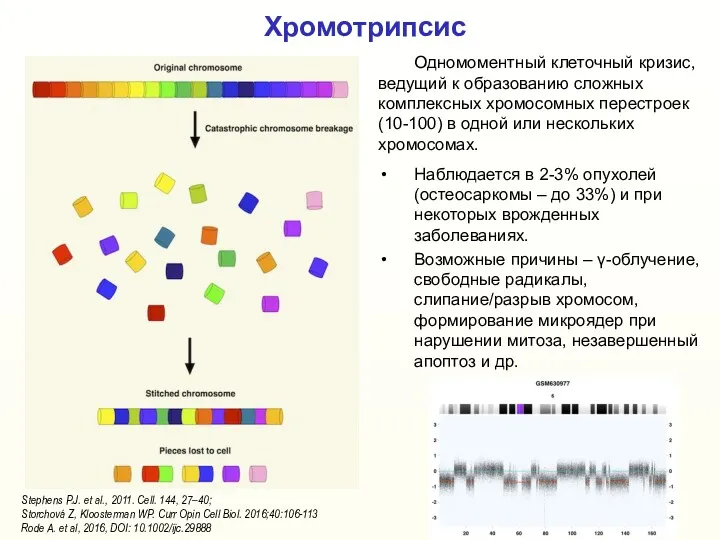
- 8. Хромотрипсис Одномоментный клеточный кризис, ведущий к образованию сложных комплексных хромосомных перестроек (10-100) в одной или нескольких
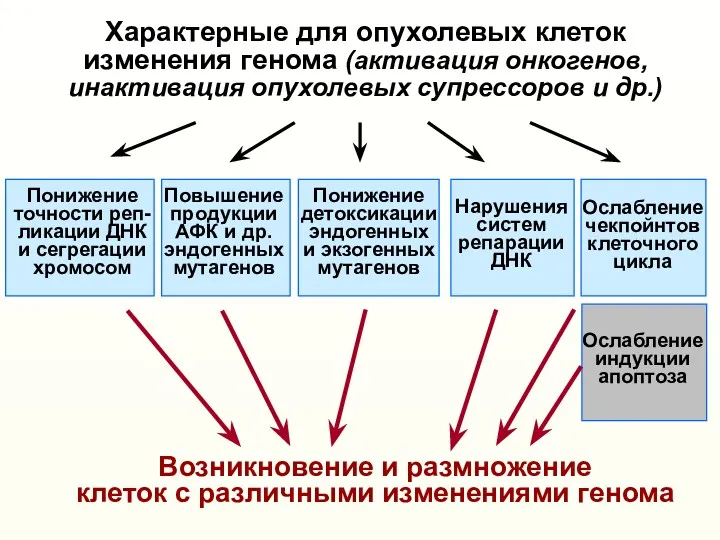
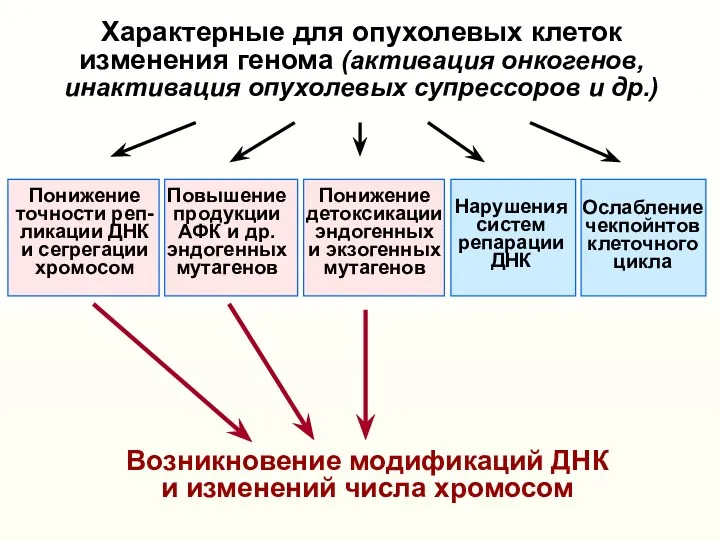
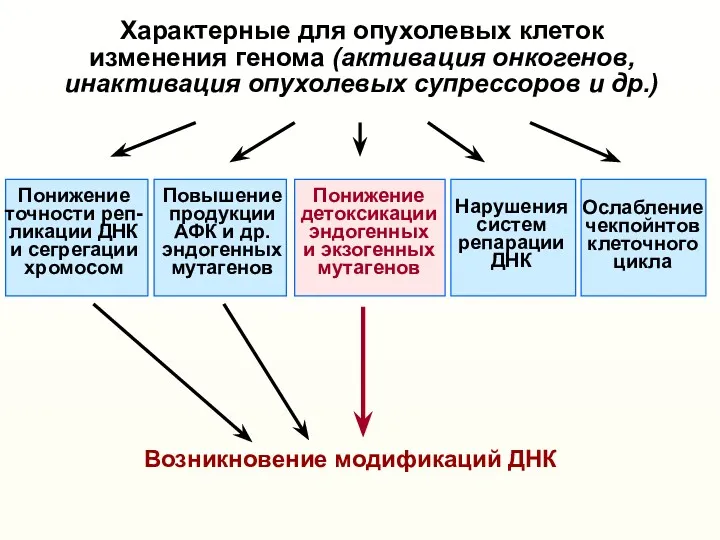
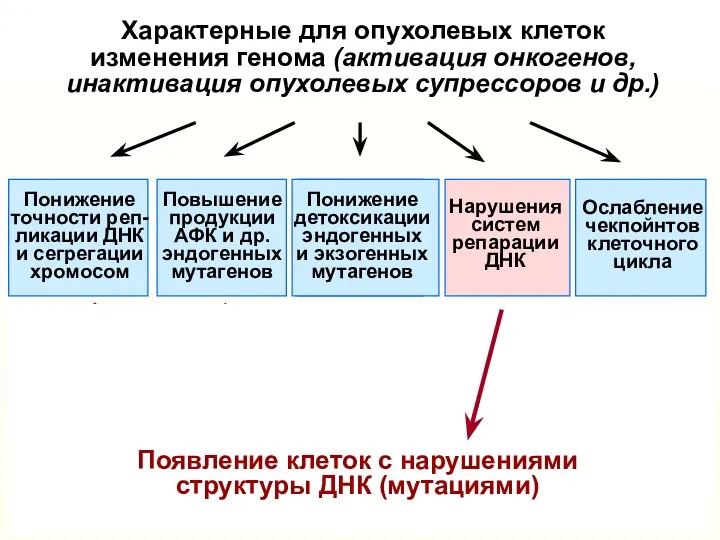
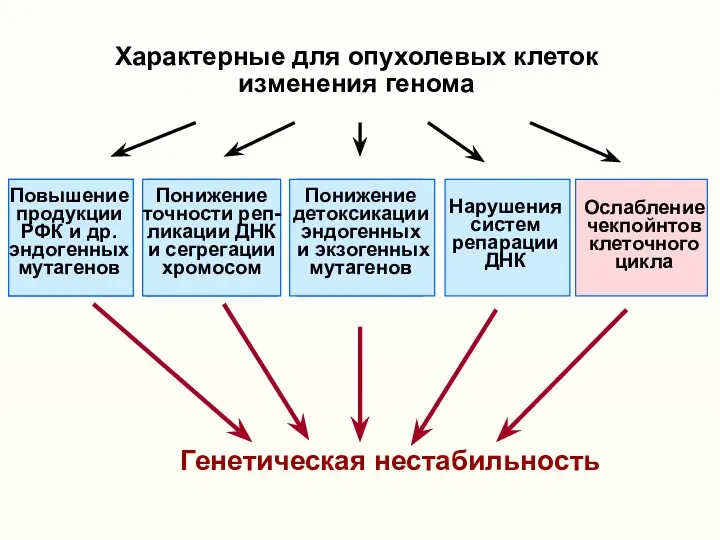
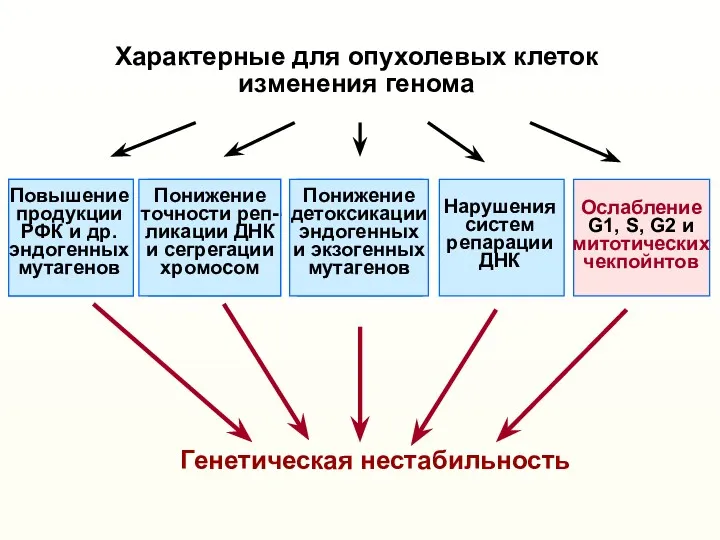
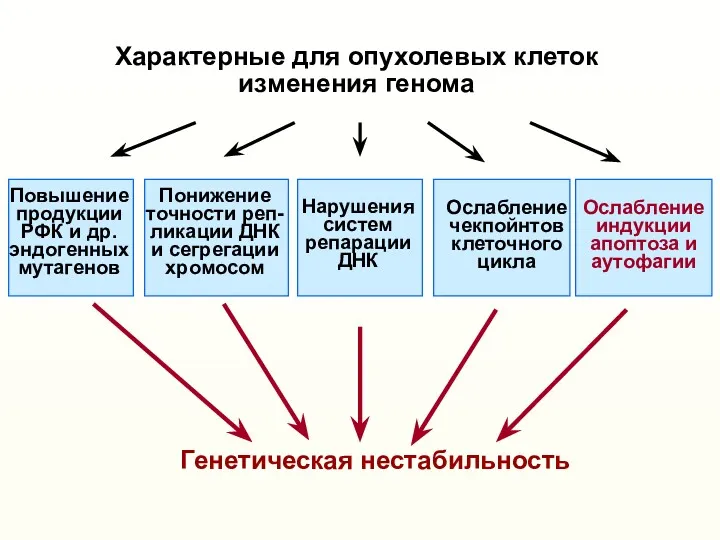
- 9. Характерные для опухолевых клеток изменения генома (активация онкогенов, инактивация опухолевых супрессоров и др.) Понижение точности реп-
- 10. Характерные для опухолевых клеток изменения генома (активация онкогенов, инактивация опухолевых супрессоров и др.) Понижение точности реп-
- 11. Мутагенные факторы: Эндогенные – а) ошибки репликации ДНК и митоза; б) внутриклеточные свободные радикалы (активные формы
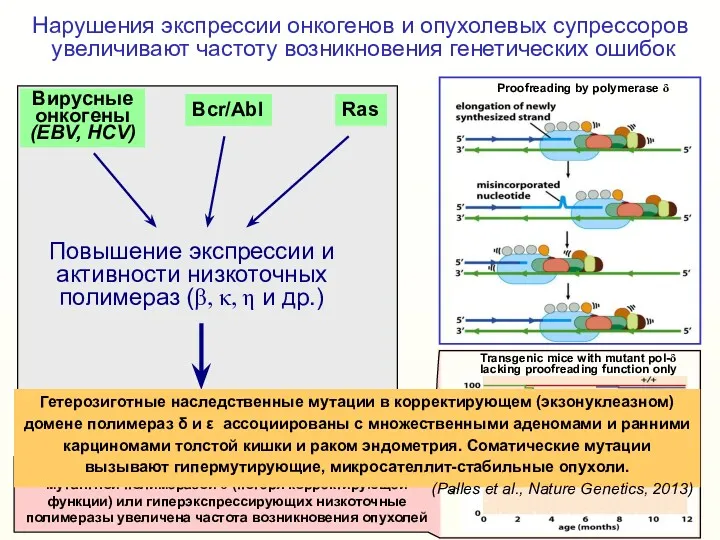
- 12. Нарушения экспрессии онкогенов и опухолевых супрессоров увеличивают частоту возникновения генетических ошибок Proofreading by polymerase δ Гетерозиготные
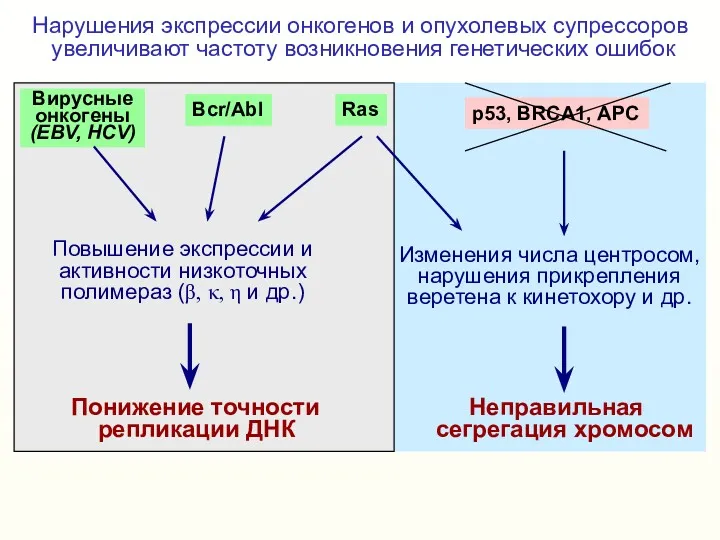
- 13. Нарушения экспрессии онкогенов и опухолевых супрессоров увеличивают частоту возникновения генетических ошибок Неправильная сегрегация хромосом Изменения числа
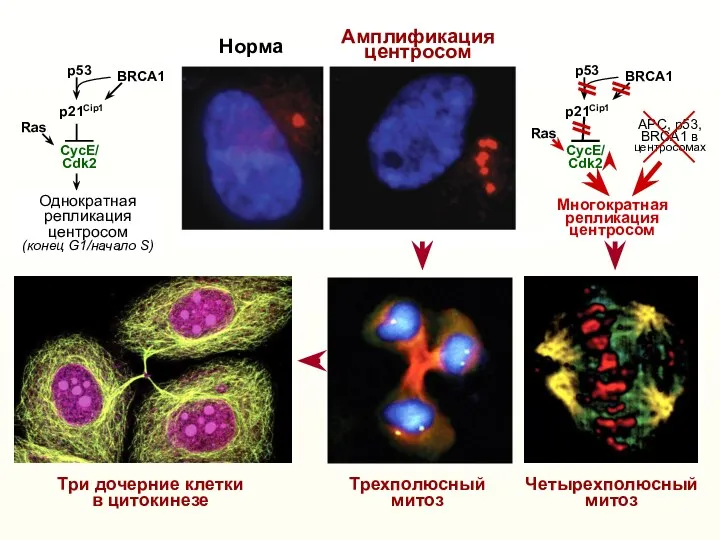
- 14. Трехполюсный митоз Амплификация центросом Норма p21Cip1 CycE/ Cdk2 Многократная репликация центросом p53 p21Cip1 CycE/ Cdk2 Однократная
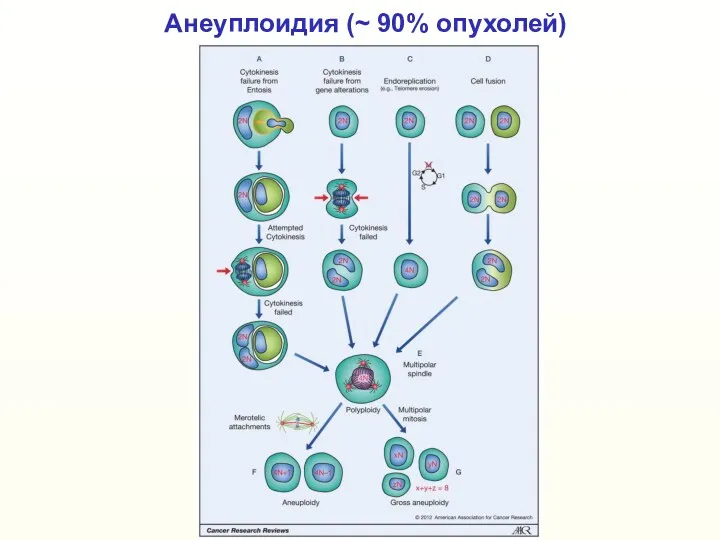
- 15. Анеуплоидия (~ 90% опухолей)
- 16. Эндогенные мутагенные факторы: а) ошибки репликации ДНК и митоза; б) внутриклеточные свободные радикалы (активные формы кислорода,
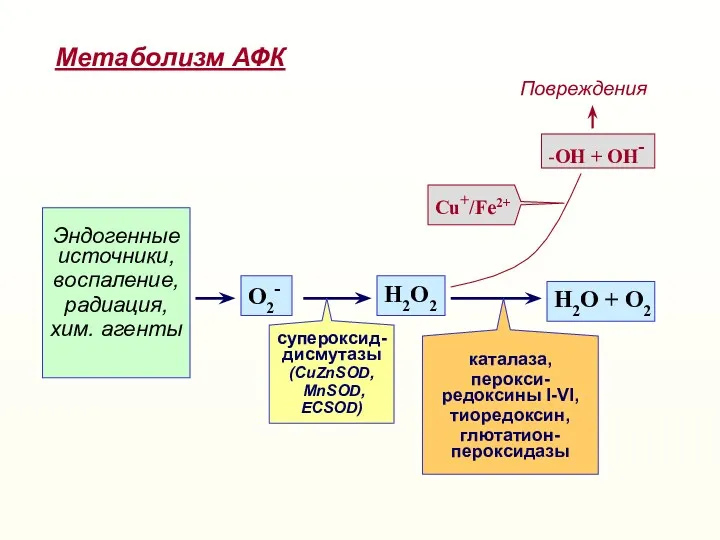
- 17. Активные формы кислорода (АФК) образуются в ходе постепенного восстановления молекул кислорода, как побочные продукты ряда внутриклеточных
- 18. Эндогенные источники, воспаление, радиация, хим. агенты О2- Н2О2 Н2О + О2 -ОН + ОН- Повреждения Cu+/Fe2+
- 19. АФК – не только повреждающие, но и важные сигнальные молекулы Окисляя компоненты различных сигнальных путей (фосфатазы
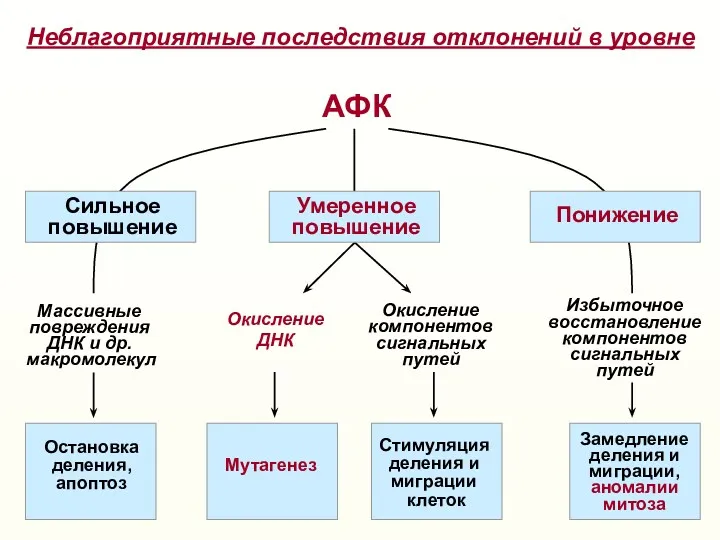
- 20. АФК Окисление ДНК Окисление компонентов сигнальных путей Массивные повреждения ДНК и др. макромолекул Сильное повышение Умеренное
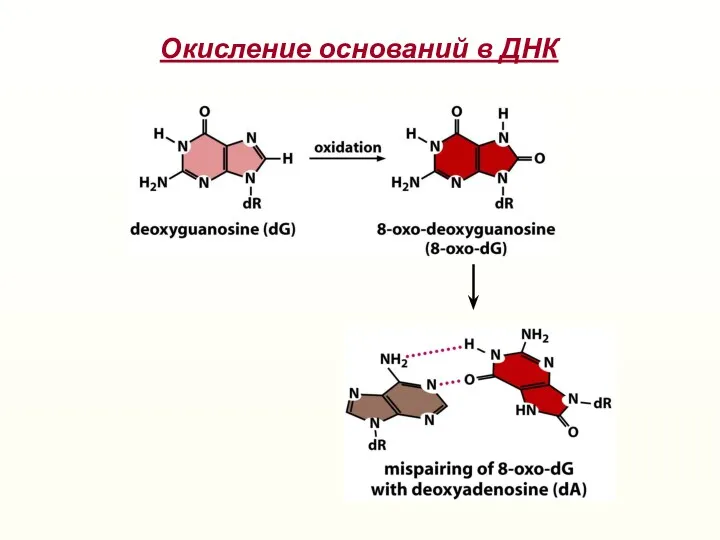
- 21. Окисление оснований в ДНК
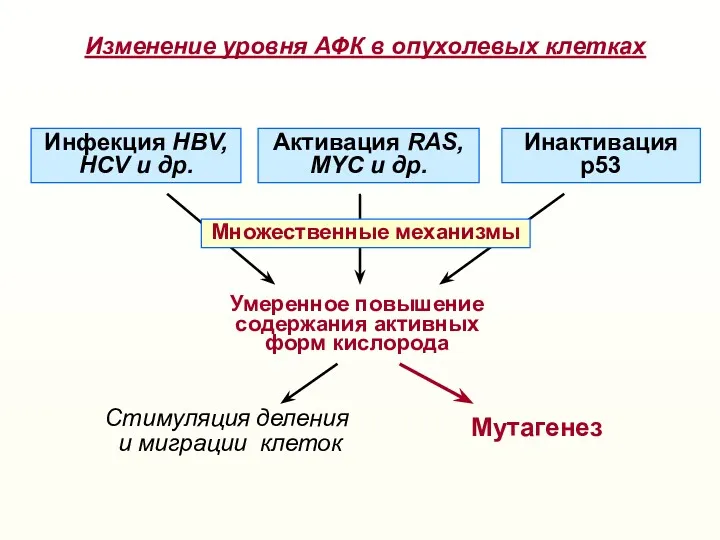
- 22. Умеренное повышение содержания активных форм кислорода Активация RAS, МYC и др. Инактивация р53 Инфекция HBV, HCV
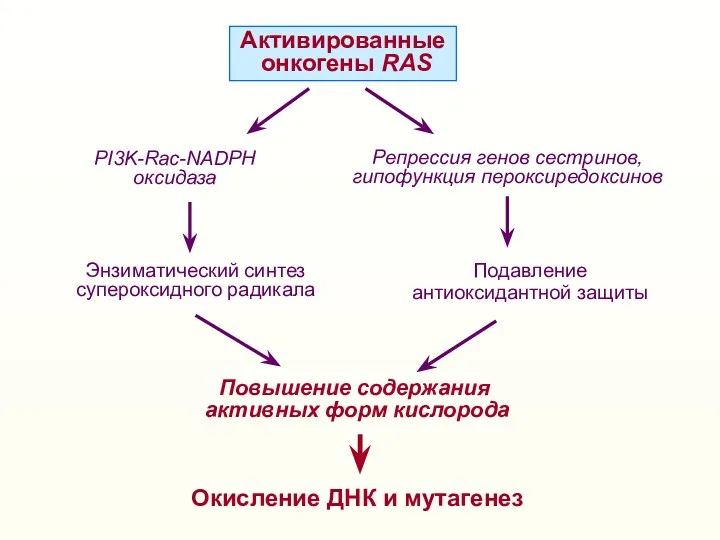
- 23. Активированные онкогены RAS Энзиматический синтез супероксидного радикала Повышение содержания активных форм кислорода Подавление антиоксидантной защиты PI3K-Rac-NADPH
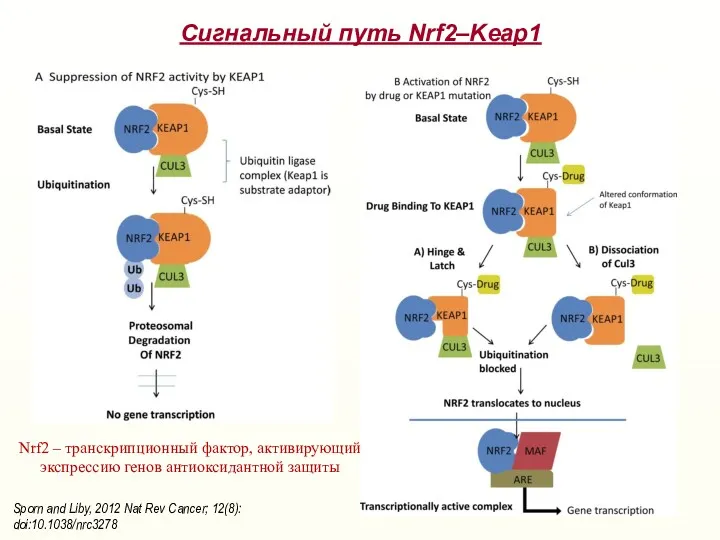
- 24. Сигнальный путь Nrf2–Keap1 Sporn and Liby, 2012 Nat Rev Cancer; 12(8): doi:10.1038/nrc3278 Nrf2 – транскрипционный фактор,
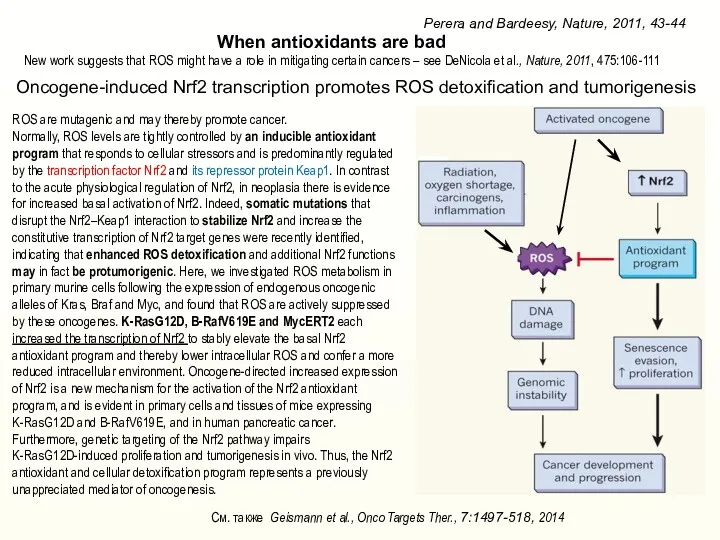
- 25. Oncogene-induced Nrf2 transcription promotes ROS detoxification and tumorigenesis Perera and Bardeesy, Nature, 2011, 43-44 When antioxidants
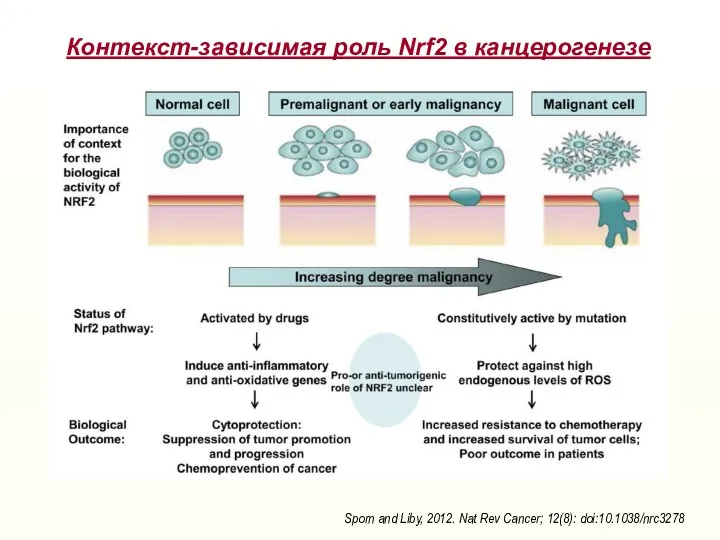
- 26. Контекст-зависимая роль Nrf2 в канцерогенезе Sporn and Liby, 2012. Nat Rev Cancer; 12(8): doi:10.1038/nrc3278
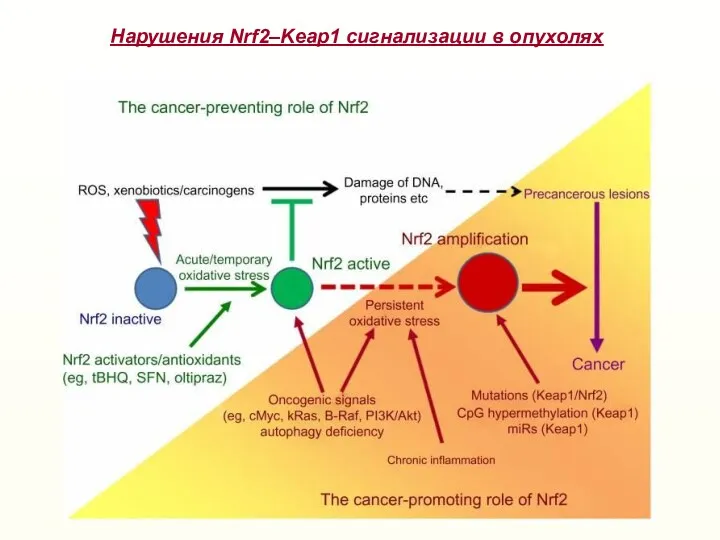
- 27. Нарушения Nrf2–Keap1 сигнализации в опухолях
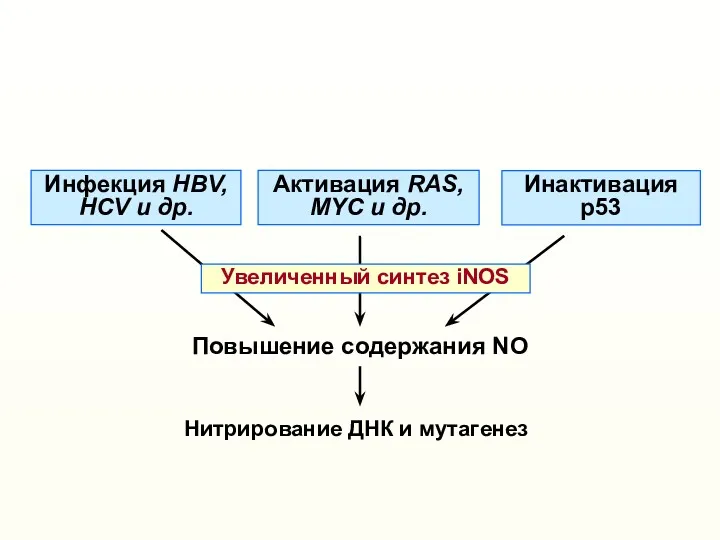
- 28. Повышение содержания NO Активация RAS, МYC и др. Инактивация р53 Инфекция HBV, HCV и др. Увеличенный
- 29. Характерные для опухолевых клеток изменения генома (активация онкогенов, инактивация опухолевых супрессоров и др.) Понижение точности реп-
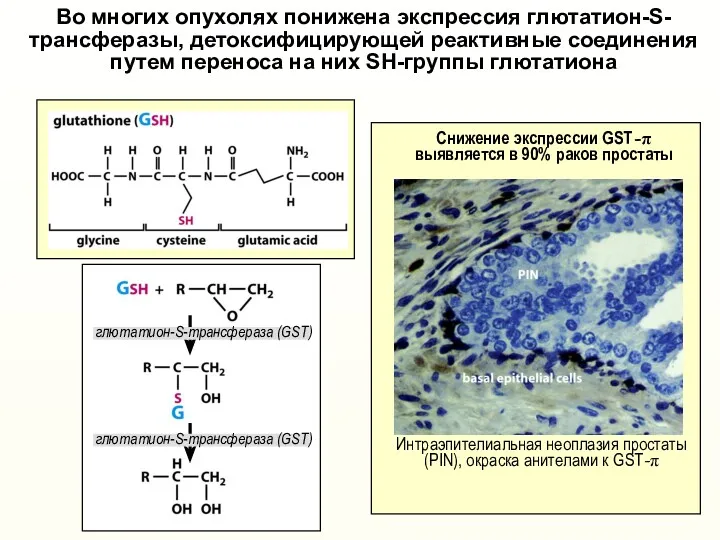
- 30. Во многих опухолях понижена экспрессия глютатион-S- трансферазы, детоксифицирующей реактивные соединения путем переноса на них SH-группы глютатиона
- 31. Характерные для опухолевых клеток изменения генома (активация онкогенов, инактивация опухолевых супрессоров и др.) Возникновение различных модификаций
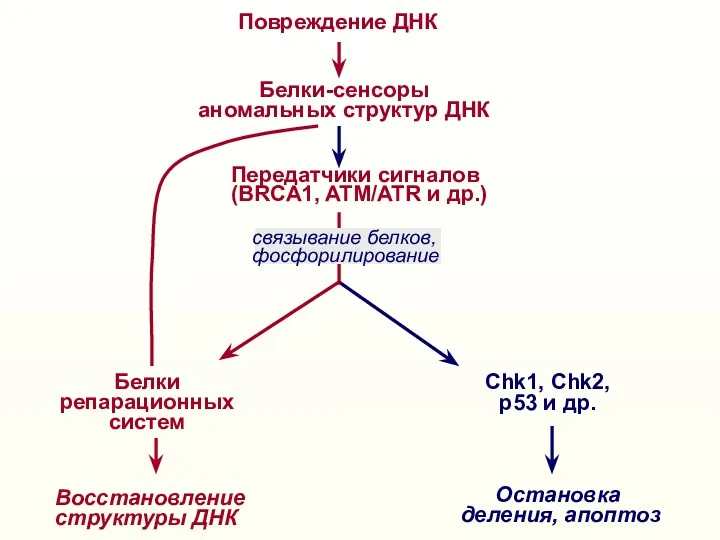
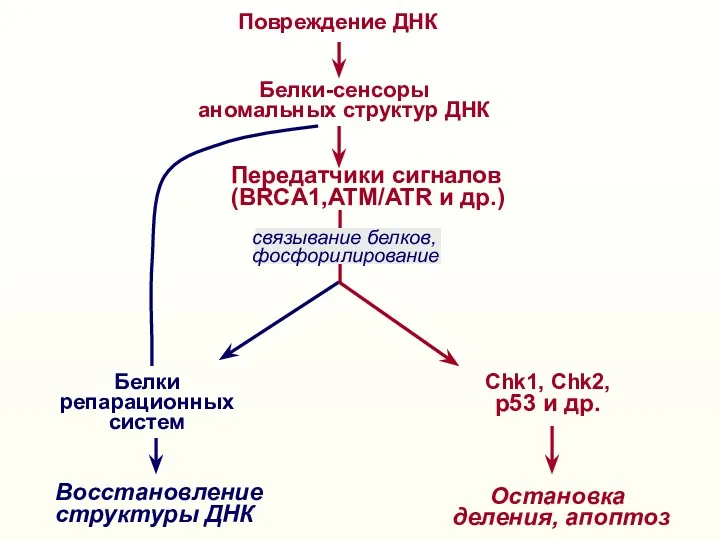
- 32. Повреждение ДНК Белки-сенсоры аномальных структур ДНК Восстановление структуры ДНК Белки репарационных систем Остановка деления, апоптоз Передатчики
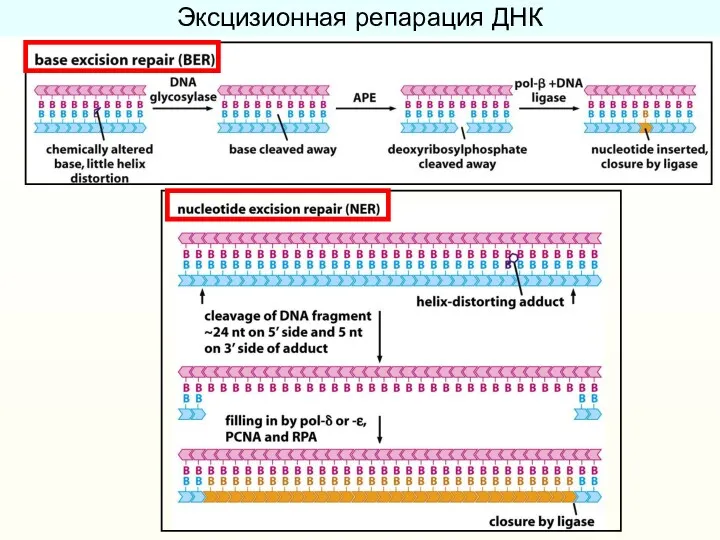
- 33. Эксцизионная репарация ДНК
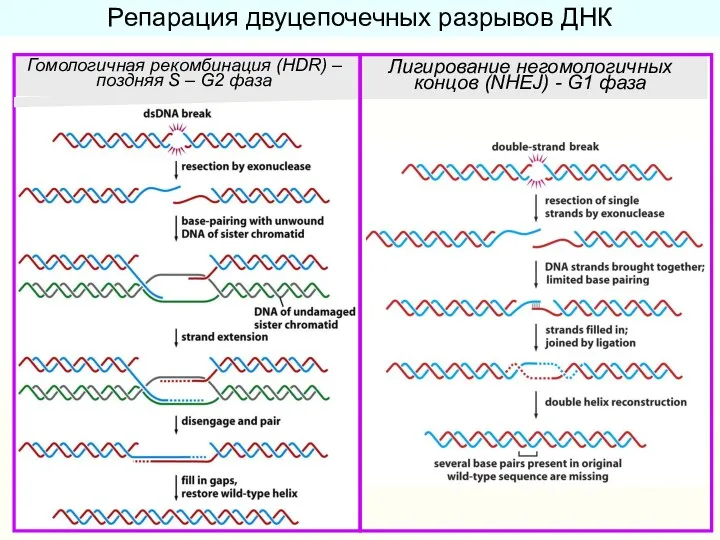
- 34. Репарация двуцепочечных разрывов ДНК Гомологичная рекомбинация (HDR) – поздняя S – G2 фаза Лигирование негомологичных концов
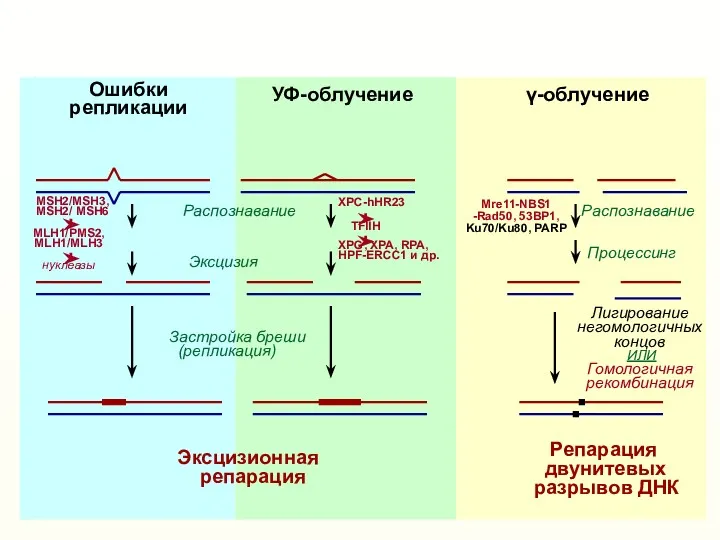
- 35. Репарация двунитевых разрывов ДНК Эксцизионная репарация Ошибки репликации γ-облучение УФ-облучение Распознавание Процессинг Лигирование негомологичных концов ИЛИ
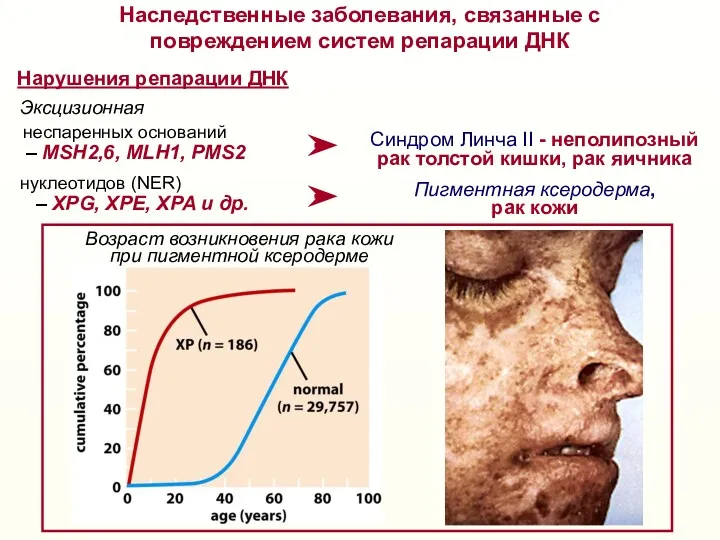
- 36. – MSH2,6, MLH1, PMS2 неспаренных оснований Нарушения репарации ДНК – XPG, XPE, XPA и др. нуклеотидов
- 37. – NBS1, LIG4 Двунитевых разрывов – FANCA, FANCG и др. Межнитевых сшивок Ниймегенский синдром, лимфоидные новообразования
- 38. Характерные для опухолевых клеток изменения генома Генетическая нестабильность Понижение точности реп- ликации ДНК и сегрегации хромосом
- 39. Повреждение ДНК Белки-сенсоры аномальных структур ДНК Восстановление структуры ДНК Белки репарационных систем Остановка деления, апоптоз Передатчики
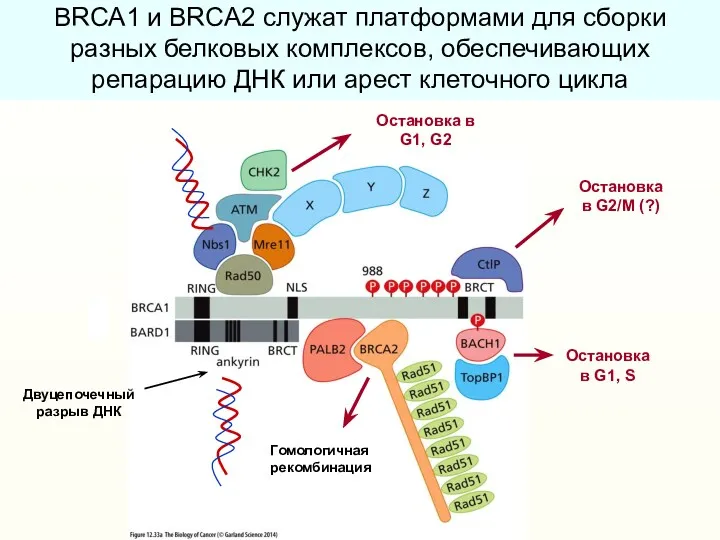
- 40. Гомологичная рекомбинация Остановка в G2/M (?) Остановка в G1, G2 Остановка в G1, S Двуцепочечный разрыв
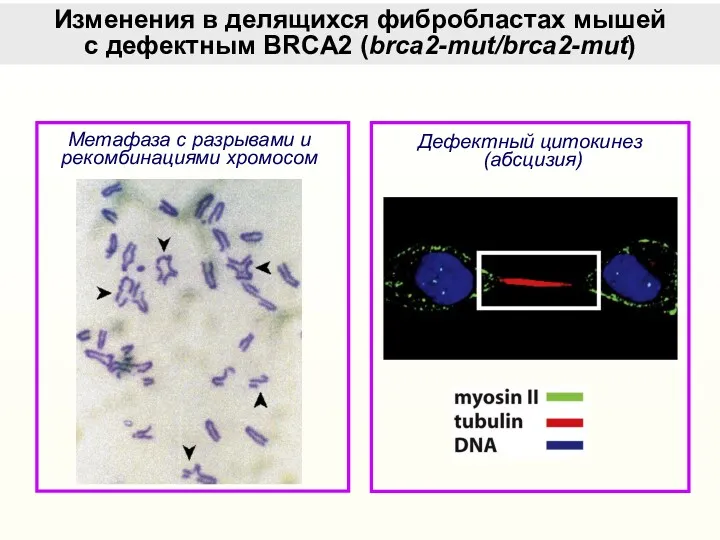
- 41. Изменения в делящихся фибробластах мышей c дефектным BRCA2 (brca2-mut/brca2-mut) Метафаза с разрывами и рекомбинациями хромосом Дефектный
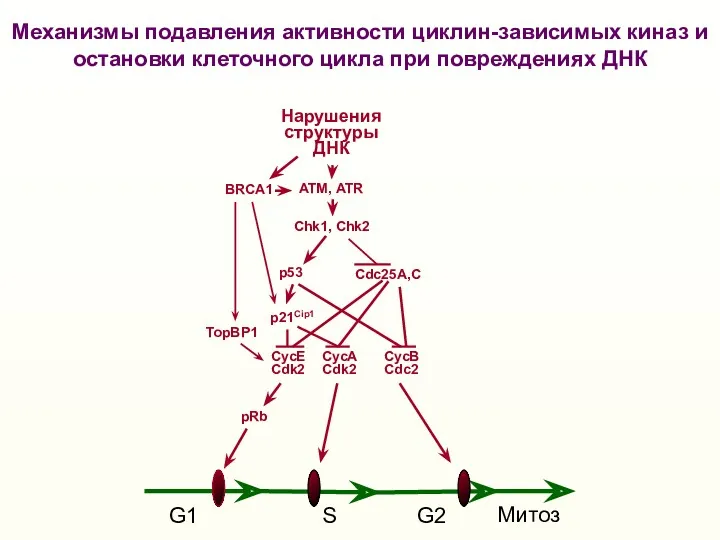
- 42. G1 S G2 Митоз Нарушения структуры ДНК p53 Механизмы подавления активности циклин-зависимых киназ и остановки клеточного
- 43. ATM Aтаксия-телеангиоэктазия, лимфолейкозы, лимфомы BRCA1, BRCA2 Рак молочной железы, яичника p53, CHK2 Синдром Ли-Фраумени – различные
- 44. Характерные для опухолевых клеток изменения генома Генетическая нестабильность Понижение точности реп- ликации ДНК и сегрегации хромосом
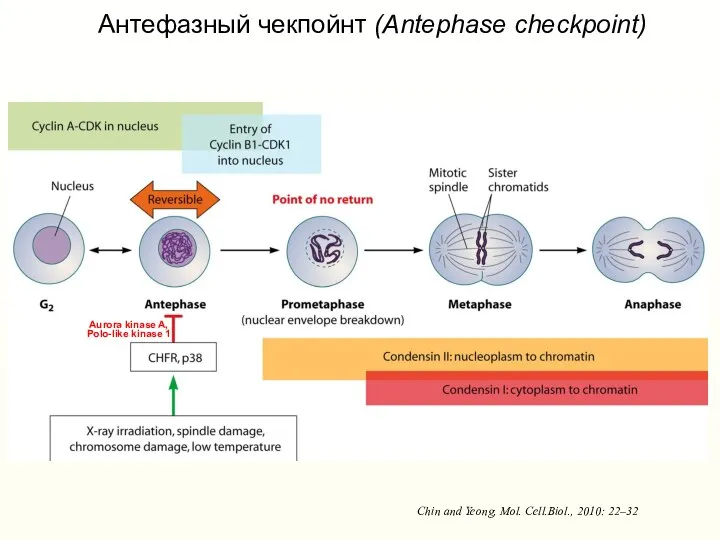
- 45. Chin and Yeong, Mol. Cell.Biol., 2010: 22–32 Антефазный чекпойнт (Antephase checkpoint) Aurora kinase A, Polo-like kinase
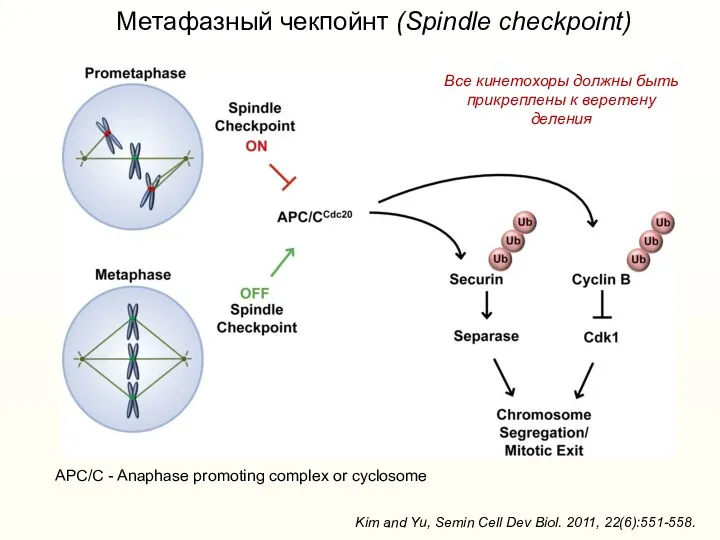
- 46. Метафазный чекпойнт (Spindle checkpoint) Kim and Yu, Semin Cell Dev Biol. 2011, 22(6):551-558. APC/C - Anaphase
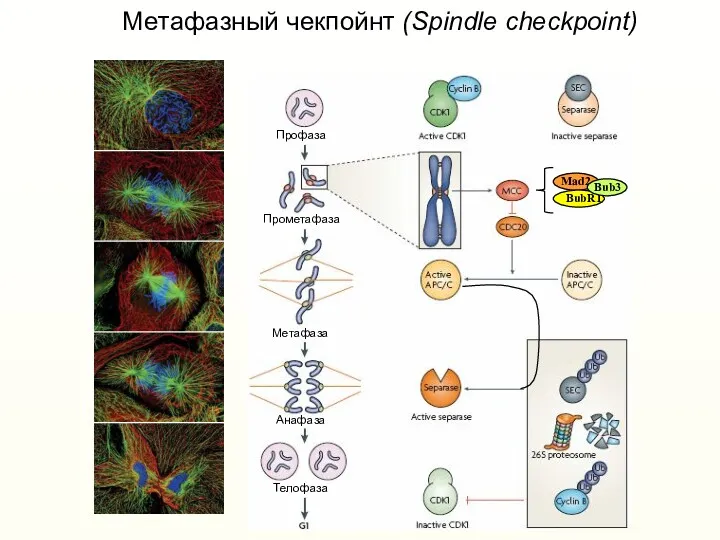
- 47. Метафазный чекпойнт (Spindle checkpoint)
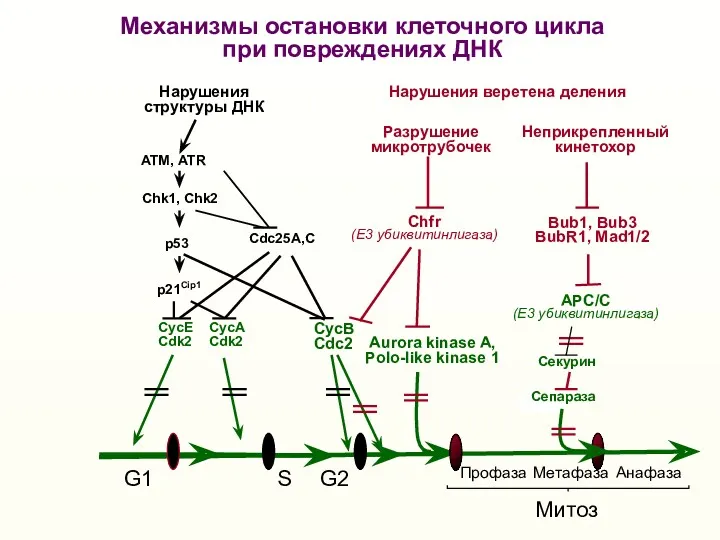
- 48. G1 S G2 Митоз Нарушения структуры ДНК Нарушения веретена деления Bub1, Bub3 BubR1, Mad1/2 p53 p21Cip1
- 49. 20-40% различных опухолей (рак желудка, носоглотки и др.) Гиперэкспрессия AURKA Многие новообразования Мутации MAD2 Bub1, Bub3,
- 50. Характерные для опухолевых клеток изменения генома Понижение точности реп- ликации ДНК и сегрегации хромосом Генетическая нестабильность
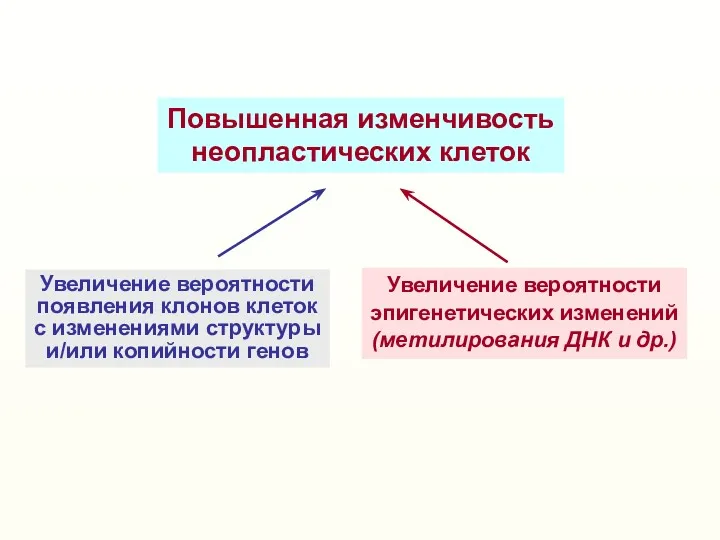
- 51. Повышенная изменчивость неопластических клеток Увеличение вероятности появления клонов клеток с изменениями структуры и/или копийности генов Увеличение
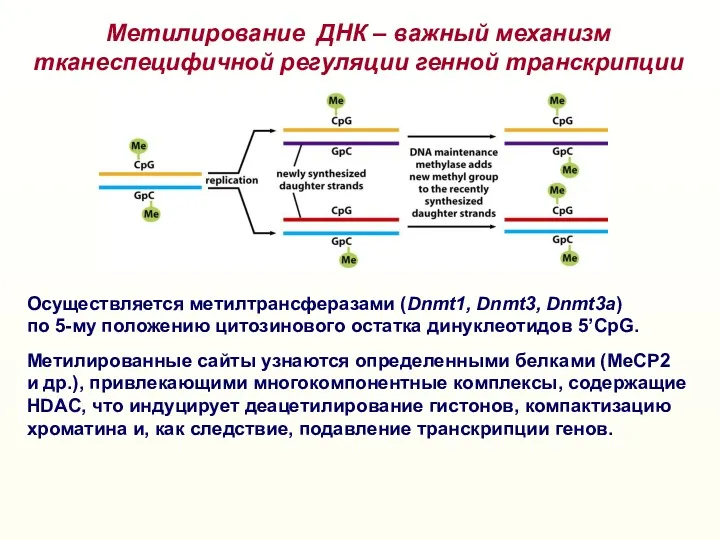
- 52. Метилирование ДНК – важный механизм тканеспецифичной регуляции генной транскрипции Осуществляется метилтрансферазами (Dnmt1, Dnmt3, Dnmt3a) по 5-му
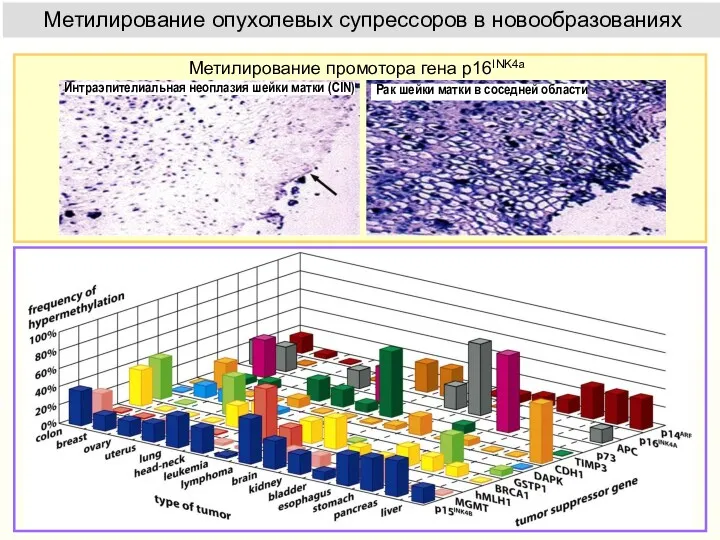
- 53. Метилирование опухолевых супрессоров в новообразованиях Метилирование промотора гена p16INK4a
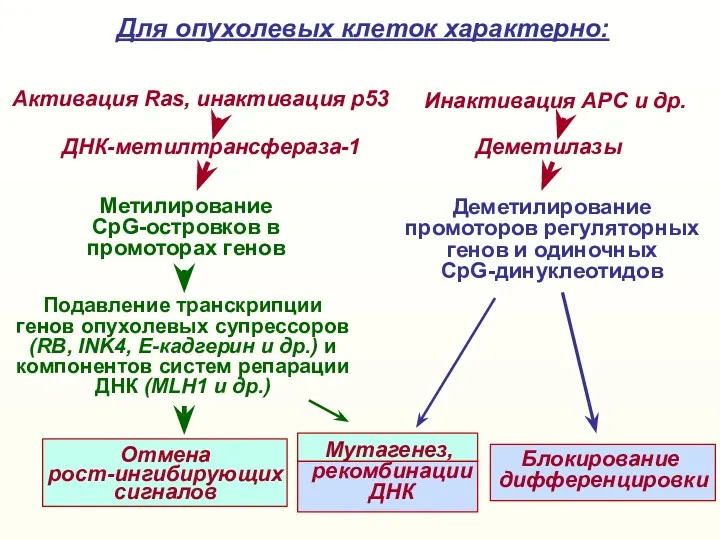
- 54. Метилирование CpG-островков в промоторах генов Для опухолевых клеток характерно: Деметилирование промоторов регуляторных генов и одиночных CpG-динуклеотидов
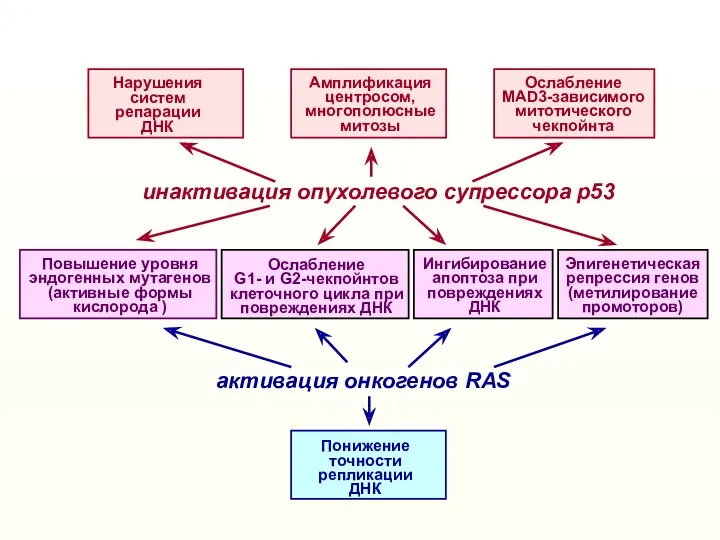
- 55. активация онкогенов RAS инактивация опухолевого супрессора р53 Понижение точности репликации ДНК Повышение уровня эндогенных мутагенов (активные
- 57. Скачать презентацию







 Фармацевтическая биоэтика
Фармацевтическая биоэтика Профессиональное выгорание среди медицинских работников: связь с ошибками и качеством медицинской помощи
Профессиональное выгорание среди медицинских работников: связь с ошибками и качеством медицинской помощи Медицина народов Средневекового Востока (2)
Медицина народов Средневекового Востока (2) Infection. Forms of infection. Immunity. Types and forms of umminity. Factors specific and nonspecific defense
Infection. Forms of infection. Immunity. Types and forms of umminity. Factors specific and nonspecific defense Лечение в Израиле
Лечение в Израиле Синдром “супер жінки”
Синдром “супер жінки” Туберкулинодиагностика
Туберкулинодиагностика Лабораторная диагностика болезней желудочно-кишечного тракта
Лабораторная диагностика болезней желудочно-кишечного тракта Заболевания паращитовидных желез
Заболевания паращитовидных желез Витамин Д3
Витамин Д3 Влияние алкоголя на здоровье человека
Влияние алкоголя на здоровье человека Ультразвуковая диапевтика в урологии
Ультразвуковая диапевтика в урологии Дифференциальный диагноз заболеваний толстой кишки
Дифференциальный диагноз заболеваний толстой кишки Кишечные вирусные инфекции
Кишечные вирусные инфекции Тістердің жоғары қажалуының емі
Тістердің жоғары қажалуының емі Лучевая терапия и радиохирургия
Лучевая терапия и радиохирургия Вакцинопрофилактика
Вакцинопрофилактика Оказание первичной медицинской помощи при перфорации половых органов на уровне ПМСП
Оказание первичной медицинской помощи при перфорации половых органов на уровне ПМСП Догляд за хворими з хірургічними захворюваннями прямої кишки
Догляд за хворими з хірургічними захворюваннями прямої кишки Балалардағы Крон ауруы
Балалардағы Крон ауруы Клиническая фармакология диуретиков
Клиническая фармакология диуретиков Транквилизаторы
Транквилизаторы Гелиотерапия
Гелиотерапия Укрепление здоровья семьи, планирование семьи
Укрепление здоровья семьи, планирование семьи ҚРда және жақын шетелде медициналық
ҚРда және жақын шетелде медициналық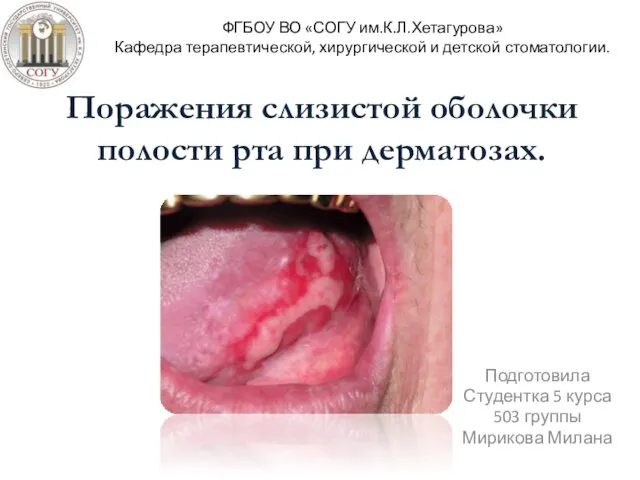 Поражения слизистой оболочки полости рта при дерматозах
Поражения слизистой оболочки полости рта при дерматозах Тики (тикозные гиперкинезы)
Тики (тикозные гиперкинезы) Врачебный контроль в спортивной медицине
Врачебный контроль в спортивной медицине