Ферментативный микроанализ. Использование в микроанализе ферментных электродов. (Лекция 6) презентация
Содержание
- 2. Ферментативный микроанализ Ферменты используются для обнаружения и количественного определения различных веществ: Металлов (Ag, Cu, Hg, Zn
- 3. Почему используют Е в ферментативном микроанализе Специфичность по отношению к S (определение S в многокомпонентной смеси,
- 4. Ферментативный микроанализ Пример: Щелочной фосфатазы используется для детекции нг количеств бериллия. Алкогольдегидрогеназа - ионы серебра (10пг/мл).
- 5. Кинетическая основа ферментативного микроанализа А→P Начальная скорость этой реакции ϑ0 пропорциональна концентрации исходного вещества [А]. ϑ0=κ[А],
- 6. Кинетическая основа ферментативного микроанализа Ферментативную реакцию останавливают через определенное время. Зная концентрацию А и измерив концентрацию
- 7. Кинетическая основа ферментативного микроанализа при определении концентрации S E + S ↔ES →P + E где
- 8. Кинетическая основа ферментативного микроанализа при определении концентрации S Согласно уравнению Михаэлиса–Ментен, концентрация субстрата [S]0 будет пропорциональна
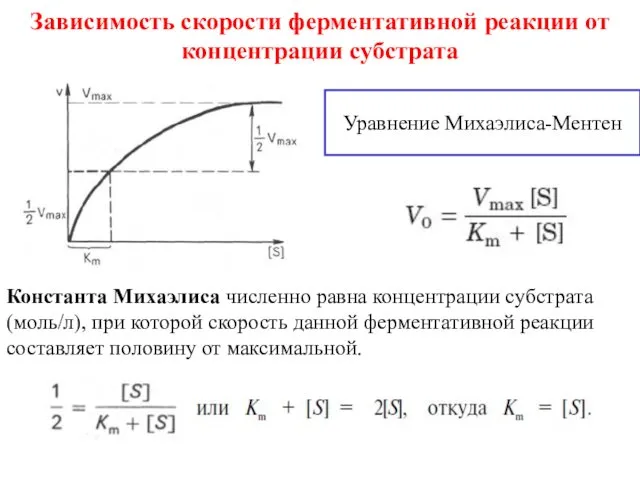
- 9. Зависимость скорости ферментативной реакции от концентрации субстрата Уравнение Михаэлиса-Ментен Константа Михаэлиса численно равна концентрации субстрата (моль/л),
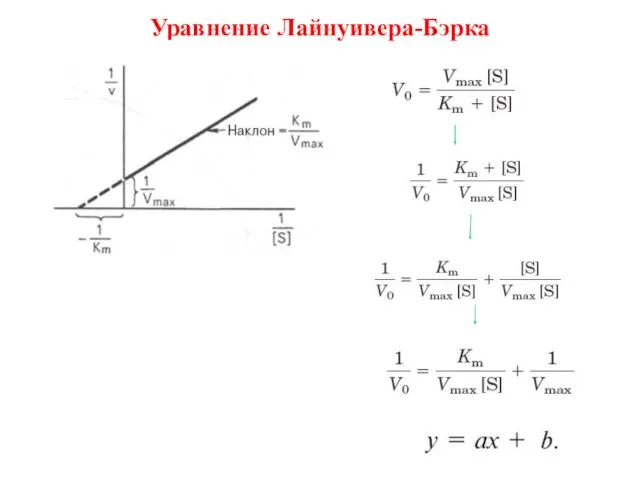
- 10. Уравнение Лайнуивера-Бэрка
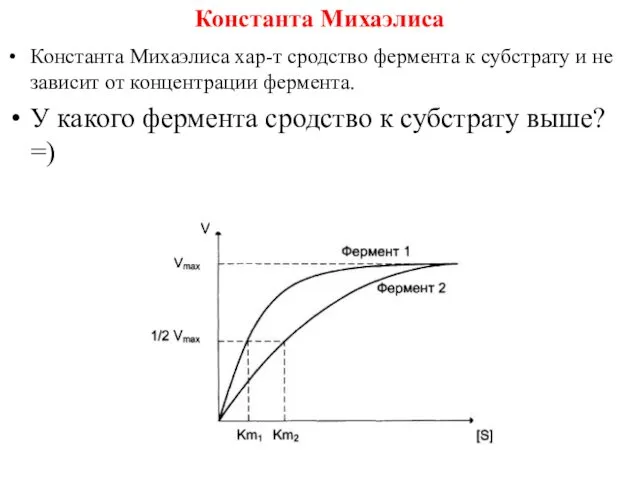
- 11. Константа Михаэлиса Константа Михаэлиса хар-т сродство фермента к субстрату и не зависит от концентрации фермента. У
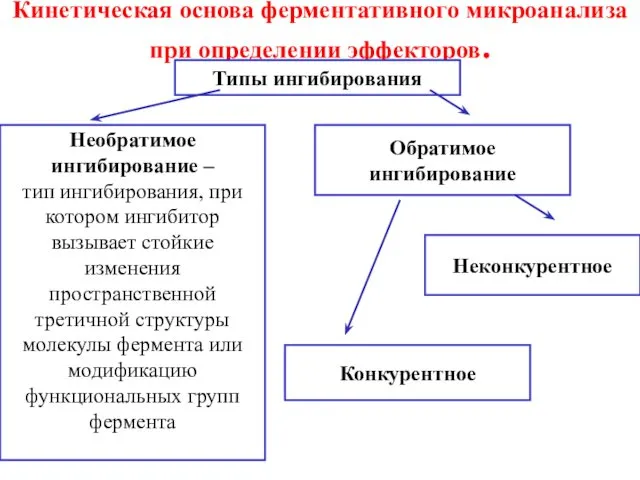
- 12. Кинетическая основа ферментативного микроанализа при определении эффекторов. Типы ингибирования Необратимое ингибирование – тип ингибирования, при котором
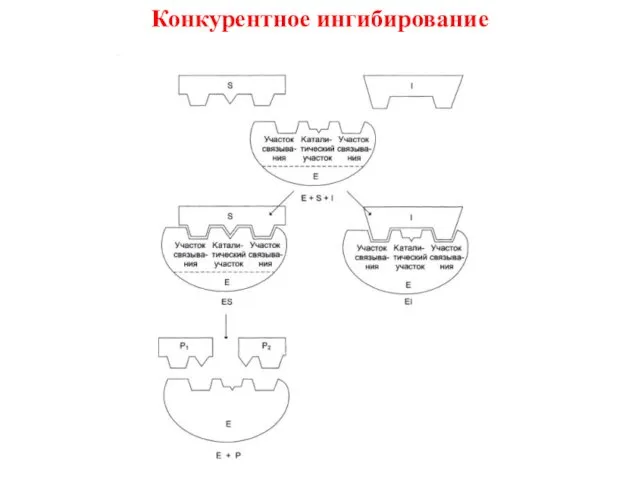
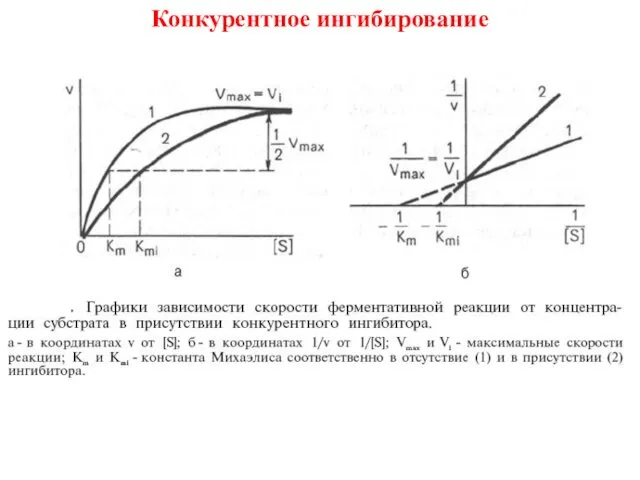
- 13. Конкурентное ингибирование
- 14. Конкурентное ингибирование
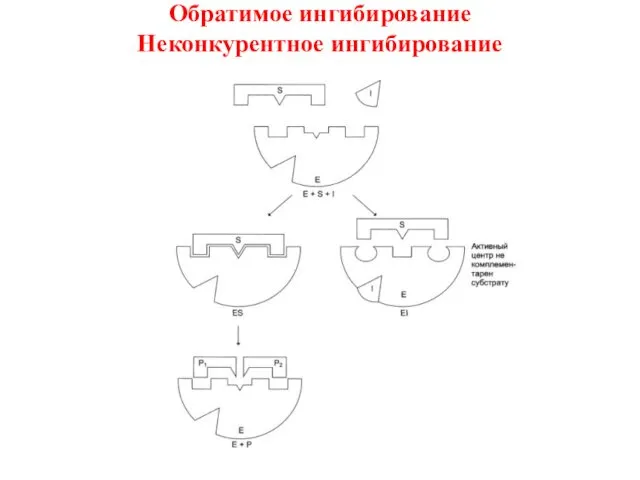
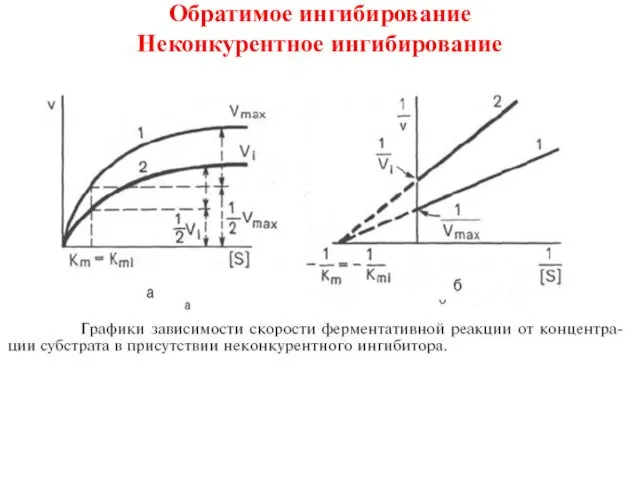
- 15. Обратимое ингибирование Неконкурентное ингибирование
- 16. Обратимое ингибирование Неконкурентное ингибирование
- 17. Кинетическая основа ферментативного микроанализа при определении эффекторов. Верхняя граница детектируемых концентраций обратимых ингибиторов определяется величиной ki.
- 18. Необратимое ингибирование Наблюдается в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего
- 19. Для необратимых ингибиторов: E + nI → Ei Уменьшение активности фермента Δ[E] будет пропорционально концентрации ингибитора:
- 20. Использование в микроанализе сопряженных ферментативных систем: Использование сопряженных ферментативных систем увеличивает чувствительность микроанализа. В живой клетке
- 22. Скачать презентацию











 Дистанционные технологии в обучении студентов-инвалидов
Дистанционные технологии в обучении студентов-инвалидов Установление империи
Установление империи Третий возраст
Третий возраст Мои работы из агальматолита
Мои работы из агальматолита Углеводы. Моносахариды
Углеводы. Моносахариды Открытое внеклассное мероприятие (классный час) Тема:Нет пожарам!
Открытое внеклассное мероприятие (классный час) Тема:Нет пожарам! Портрет класса
Портрет класса Учимся создавать компьютерные презентации в программе PowerPoint
Учимся создавать компьютерные презентации в программе PowerPoint Российская империя. Экономическое развитие страны
Российская империя. Экономическое развитие страны Психологическая и речевая готовностьдетейк школе
Психологическая и речевая готовностьдетейк школе Дикие животные. Загадки для дошкольников
Дикие животные. Загадки для дошкольников Экологическое воспитание,как одно из практических направлений в привитии гуманного отношения к природе у младших школьников с ОВЗ
Экологическое воспитание,как одно из практических направлений в привитии гуманного отношения к природе у младших школьников с ОВЗ Решение квадратных уравнений. 8 класс
Решение квадратных уравнений. 8 класс Презентация Белки жиры и углеводы
Презентация Белки жиры и углеводы За здоровый образ жизни
За здоровый образ жизни Презентация с использованием интерактивной доски Недаром помнит вся Россия про день Бородина
Презентация с использованием интерактивной доски Недаром помнит вся Россия про день Бородина Что такое степень с натуральным показателем. Урок 49
Что такое степень с натуральным показателем. Урок 49 Соул коллаж (Soul Collage), автор Сиена Фрост
Соул коллаж (Soul Collage), автор Сиена Фрост Задачи на построение треугольника. Урок геометрии в 7 классе
Задачи на построение треугольника. Урок геометрии в 7 классе 2018 – год единства народов России
2018 – год единства народов России Методика развития речи на уроках русского языка в 6 классе
Методика развития речи на уроках русского языка в 6 классе Современные теории и концепции обучения
Современные теории и концепции обучения Определение бизнес-плана и его роль в современном предпринимательстве
Определение бизнес-плана и его роль в современном предпринимательстве Увертюра фантазия Ромео и Джульетта
Увертюра фантазия Ромео и Джульетта Состояние местной неспецифической резистентности организма при дисбактериозе у беременных женщин
Состояние местной неспецифической резистентности организма при дисбактериозе у беременных женщин Кинематика. Решение задач
Кинематика. Решение задач Лепка кота из соленого теста или пластилина.
Лепка кота из соленого теста или пластилина. Создание проблемных ситуаций на занятиях в процессе обучения искусству прессованной флористики
Создание проблемных ситуаций на занятиях в процессе обучения искусству прессованной флористики