Слайд 2

Специфические особенности органических реакций
Реакции идут медленнее
Чаще требуют жестких условий для их
осуществления:
Повышение температуры
Катализатор
Давление
Облучение УФ светом
Слайд 3

Специфические особенности органических реакций
Реакции протекают в несколько стадий, поэтому редко дают
высокий выход продукта
Вместо уравнений – схема, над условия реакций: t, p, катализатор.
Изменяется не вся молекула, а только её части – реакционные центры молекулы
Слайд 4
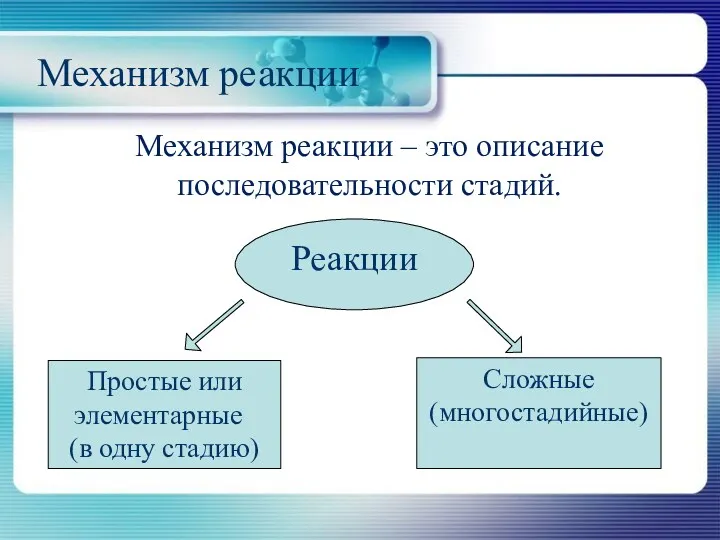
Механизм реакции
Механизм реакции – это описание последовательности стадий.
Реакции
Простые или элементарные
(в одну стадию)
Сложные (многостадийные)
Слайд 5
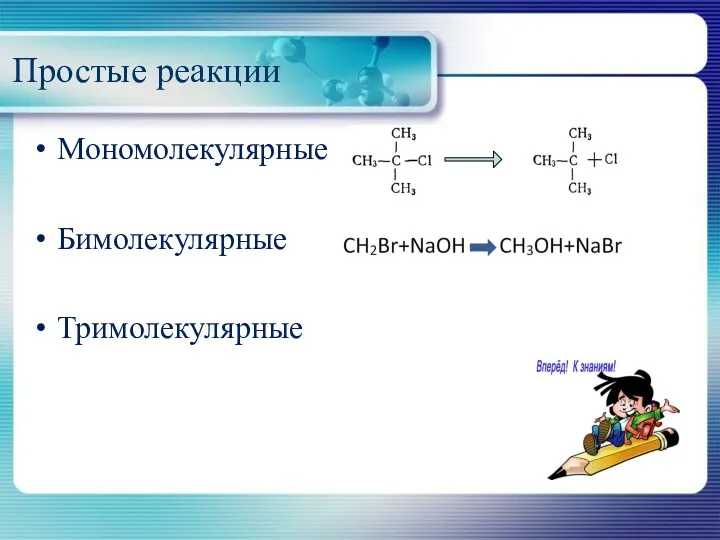
Простые реакции
Мономолекулярные
Бимолекулярные
Тримолекулярные
Слайд 6

Сложные реакции
Хлорирование метана -
реакция замещения
Слайд 7

1 стадия-зарождение цепи (инициирование)
Хлорирование метана
Слайд 8
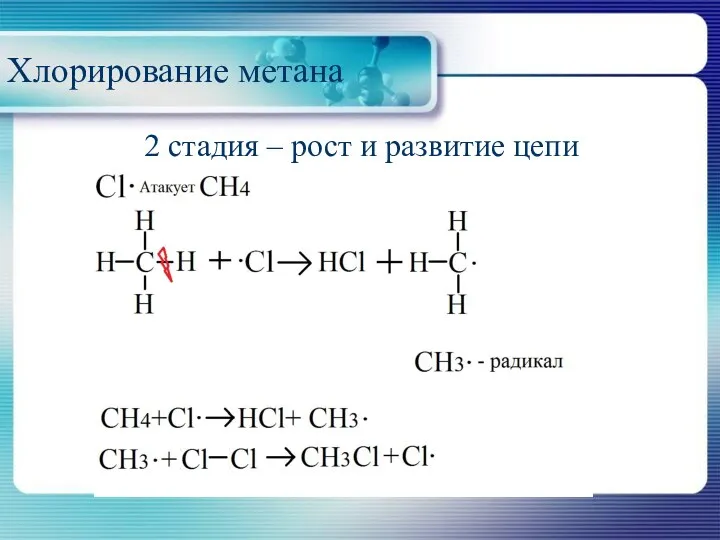
Хлорирование метана
2 стадия – рост и развитие цепи
Слайд 9

Хлорирование метана
3 стадия – обрыв цепи
Слайд 10
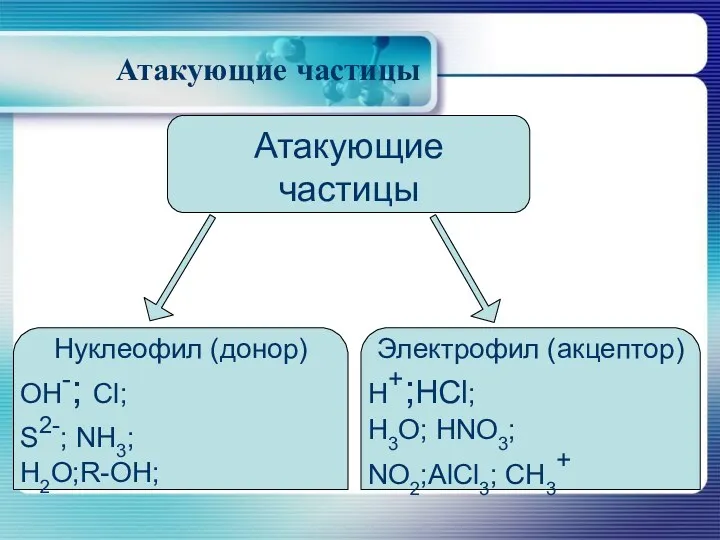
Атакующие частицы
Атакующие частицы
Нуклеофил (донор)
OH-; Cl;
S2-; NH3;
H2O;R-OH;
Электрофил (акцептор)
H+;HCl;
H3O; HNO3;
NO2;AlCl3; CH3+
Слайд 11

Способы разрыва химических связей
Гомолитический (радикальный)
Гетеролитический (ионный)
Слайд 12

Гомолитический разрыв химической связи
Гомолитический разрыв ковалентной связи (радикальный)
Радикалы:
CH3CH2
Cl
Слайд 13

Гомолитический разрыв химической связи
Гомолизу подвергаются:
Неполярные связи (С-С; Сl-Cl)
Малополярные связи (С-Н)
Гомолиз осуществляется
При высокой температуре
На свету
В отсутствии растворителя
Слайд 14

Гетеролитический разрыв химической связи
Гетеролитические (электрофильные-нуклеофильные или ионные) реакции:













 Государственные заказы в системе государственного регулирования экономики
Государственные заказы в системе государственного регулирования экономики САУТ-ЦМ/485. Локомотивные устройства
САУТ-ЦМ/485. Локомотивные устройства понятие десятичной дроби 6 класс
понятие десятичной дроби 6 класс Презентация Учитель здоровья-2012
Презентация Учитель здоровья-2012 Государственное регулирование в сфере культуры
Государственное регулирование в сфере культуры Рифма и ритм. Урок литературы в 6 классе
Рифма и ритм. Урок литературы в 6 классе Святые жены-мироносицы
Святые жены-мироносицы Начало колониальных захватов и создания колониальных империй
Начало колониальных захватов и создания колониальных империй Технології і принципи побудови автоматизованих систем для неруйнівного контролю відповідальних зварних конструкцій
Технології і принципи побудови автоматизованих систем для неруйнівного контролю відповідальних зварних конструкцій Компьютербасты адамдар
Компьютербасты адамдар Презентация к классному часу Что такое настоящая дружба?
Презентация к классному часу Что такое настоящая дружба? Биомы суши. Саванны
Биомы суши. Саванны Возникновение постмодернизма
Возникновение постмодернизма Психология обучения. Дидактика
Психология обучения. Дидактика Онлайн-кассы: применение, подбор оптимальной ККТ, наиболее частые ошибки
Онлайн-кассы: применение, подбор оптимальной ККТ, наиболее частые ошибки Основы шрифта и технологии графики. Построение шрифта Антиква
Основы шрифта и технологии графики. Построение шрифта Антиква Презентация для старшего дошкольного возраста.
Презентация для старшего дошкольного возраста. Омонимы, паронимы, синонимы, антонимы и их употребление
Омонимы, паронимы, синонимы, антонимы и их употребление Родительское собрание: Книги в семье.
Родительское собрание: Книги в семье. Нормативы технической эксплуатации. Основы технической эксплуатации подвижного состава. Тема 8
Нормативы технической эксплуатации. Основы технической эксплуатации подвижного состава. Тема 8 Текущее содержание железнодорожного пути
Текущее содержание железнодорожного пути Маркировка и выбор абразивного инструмента
Маркировка и выбор абразивного инструмента Radars for various purposes
Radars for various purposes Торжественная линенйка, посвященная инаугурации президента школы
Торжественная линенйка, посвященная инаугурации президента школы Географический адрес объектов. Тест
Географический адрес объектов. Тест Презентация. Развитие связной речи. Тема Сластёна
Презентация. Развитие связной речи. Тема Сластёна Инновационные технологии для транспортного и инфраструктурного строительства с применением металлических конструкций
Инновационные технологии для транспортного и инфраструктурного строительства с применением металлических конструкций Птахівництво як галузь тваринництва
Птахівництво як галузь тваринництва