Содержание
- 2. АЛЮМИНИЙ Его физические и химические свойства
- 3. I. Характеристика химического элемента: Порядковый номер Относительная атомная масса Заряд ядра атома Число протонов Число электронов
- 4. Al 27 +13 0 2 8 3 Электронная формула Строение электронной оболочки: Степень окисления алюминия в
- 5. II. Физические свойства алюминия: Алюминий – металл серебристо- белого цвета, лёгкий t пл.=6600С, ковок, пластичен, электро-
- 6. III. Химические свойства алюминия: Алюминий – активный металл? Al - 3ē Al восстановитель +3 0
- 7. 1. Взаимодействие алюминия с простыми веществами:
- 8. 2. Взаимодействие алюминия со сложными веществами: с кислотами со щелочами с солями с оксидами Инструкционная карта
- 10. Проверим свои знания ! 1 В 2 Б, В,Г, 3 А, В 4 В 5 В
- 11. Подведение итогов урока Рефлексия Над какой темой мы сегодня работали? Что нового вы узнали об алюминии?
- 12. Домашнее задание: § 16, стр 107-111 вопросы 4– обязательная часть Индивидуальная часть: 1.Составьте текст рекламы алюминия
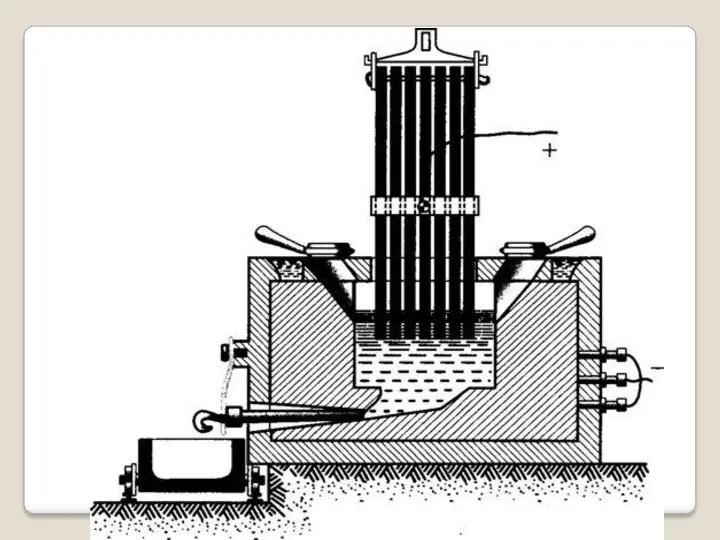
- 13. Алюминий Получение главная Далее
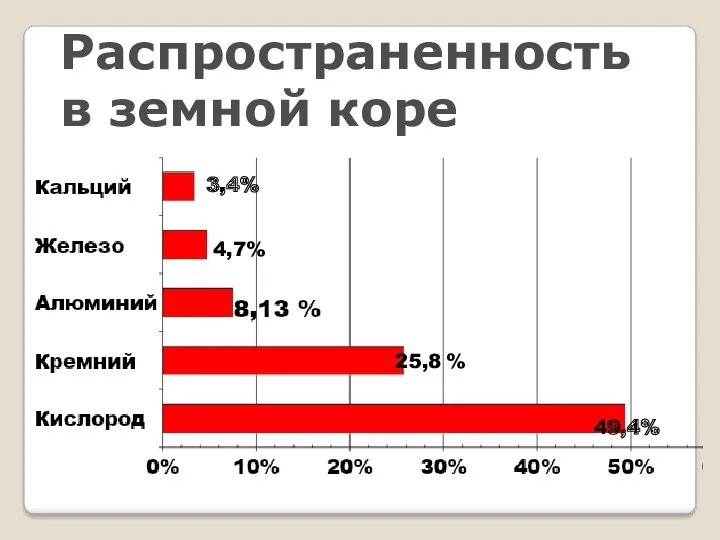
- 15. Распространенность в земной коре 25,8 % 49,4% 4,7% 3,4%
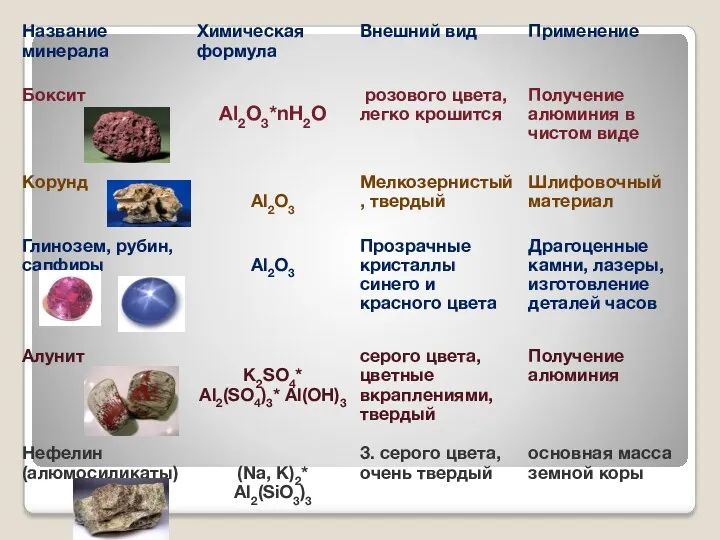
- 17. Корунд - наиболее устойчивая модификация оксида алюминия
- 18. Al2O3 + 6HCl = 2AlCl3 + 3H2O сплавление Al2O3 + 2NaOH = 2NaAlO2 + H2O Al2O3
- 19. Гидроксид адюминия (гидраргиллит) Свежеосаждённый гидроксид алюминия может взаимодействовать с: кислотами щелочами В растворах: При сплавлении: При
- 20. Соли алюминия Безводный хлорид алюминия АlСl3 используется в химической практике в качестве катализатора при переработке нефти
- 22. Скачать презентацию















 Проект планировки территории, ограниченной магистралью непрерывного движения Уфа-аэропорт
Проект планировки территории, ограниченной магистралью непрерывного движения Уфа-аэропорт Классный час памяти Юрия Гагарина Он был первым.
Классный час памяти Юрия Гагарина Он был первым. Научная конференция в АСОУ г.Москва
Научная конференция в АСОУ г.Москва Небулайзерная терапия. современные технологии
Небулайзерная терапия. современные технологии Мир и человек на телеэкране. Репортаж и интервью – основные телевизионные жанры
Мир и человек на телеэкране. Репортаж и интервью – основные телевизионные жанры Свет в жизни живых организмов
Свет в жизни живых организмов Роль драматизации в жизни дошкольника
Роль драматизации в жизни дошкольника Реабилитация онкологических больных
Реабилитация онкологических больных Презентация конкурсаУши,ноги,хвосты
Презентация конкурсаУши,ноги,хвосты Характеристика холодильного оборудования
Характеристика холодильного оборудования Аллергические реакции
Аллергические реакции РНК. Эволюция РНК-полимераз. (Лекция 7-8)
РНК. Эволюция РНК-полимераз. (Лекция 7-8) Правовой режим пригородных зон
Правовой режим пригородных зон Развивающие игры палочки Кюизенера
Развивающие игры палочки Кюизенера Термообработка стали
Термообработка стали Климат России
Климат России Веганство
Веганство Творческий отчет
Творческий отчет Презентация Интеллект-карта как метод формирования учебно-познавательной компетенции обучающихся.
Презентация Интеллект-карта как метод формирования учебно-познавательной компетенции обучающихся. Packaging Materials
Packaging Materials Христианство. Источники вероучения
Христианство. Источники вероучения Виды регионарной анестезии в клинической практике. Современные местные анестетики
Виды регионарной анестезии в клинической практике. Современные местные анестетики Школьный музей Диск
Школьный музей Диск Зимующие птицы
Зимующие птицы Существование Земли
Существование Земли Подбор окон в жилых помещениях
Подбор окон в жилых помещениях Технология сборки и сварки двутавровой балки 500 на автоматических линиях
Технология сборки и сварки двутавровой балки 500 на автоматических линиях Второстепенные члены предложения
Второстепенные члены предложения