Содержание
- 2. Катодные процессы в водных растворах электролитов
- 3. Изменение восстановительной активности анионов Анионы по их способности окисляться располагаются в следующем порядке: I-, Br-, S2-,
- 4. Анодные процессы в водных растворах электролитов
- 5. Электролиз раствора поваренной соли
- 6. Электролиз раствора хлорида натрия NaСl (-)Катод Na+ + Cl- Анод(+) Восстановление NaOH окисление анионов молекул воды:
- 7. Электролиз раствора сульфата меди (II) CuSO4 (-)Катод Cu2+ + SO42- Анод(+) восстановление окисление ионов меди: H2SO4
- 8. Электролиз раствора сульфата калия К2SO4 (-)Катод 2К+ + SO42- Анод(+) восстановление окисление молекул воды молекул воды
- 10. Скачать презентацию







 Государственные заказы в системе государственного регулирования экономики
Государственные заказы в системе государственного регулирования экономики САУТ-ЦМ/485. Локомотивные устройства
САУТ-ЦМ/485. Локомотивные устройства понятие десятичной дроби 6 класс
понятие десятичной дроби 6 класс Презентация Учитель здоровья-2012
Презентация Учитель здоровья-2012 Государственное регулирование в сфере культуры
Государственное регулирование в сфере культуры Рифма и ритм. Урок литературы в 6 классе
Рифма и ритм. Урок литературы в 6 классе Святые жены-мироносицы
Святые жены-мироносицы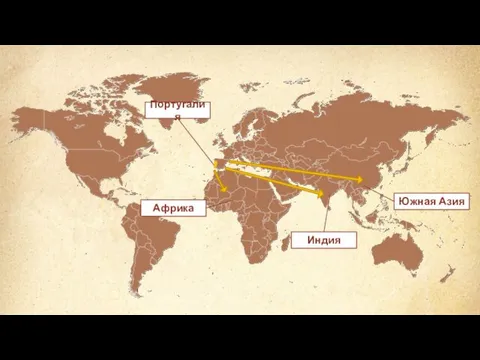 Начало колониальных захватов и создания колониальных империй
Начало колониальных захватов и создания колониальных империй Технології і принципи побудови автоматизованих систем для неруйнівного контролю відповідальних зварних конструкцій
Технології і принципи побудови автоматизованих систем для неруйнівного контролю відповідальних зварних конструкцій Компьютербасты адамдар
Компьютербасты адамдар Презентация к классному часу Что такое настоящая дружба?
Презентация к классному часу Что такое настоящая дружба? Биомы суши. Саванны
Биомы суши. Саванны Возникновение постмодернизма
Возникновение постмодернизма Психология обучения. Дидактика
Психология обучения. Дидактика Онлайн-кассы: применение, подбор оптимальной ККТ, наиболее частые ошибки
Онлайн-кассы: применение, подбор оптимальной ККТ, наиболее частые ошибки Основы шрифта и технологии графики. Построение шрифта Антиква
Основы шрифта и технологии графики. Построение шрифта Антиква Презентация для старшего дошкольного возраста.
Презентация для старшего дошкольного возраста. Омонимы, паронимы, синонимы, антонимы и их употребление
Омонимы, паронимы, синонимы, антонимы и их употребление Родительское собрание: Книги в семье.
Родительское собрание: Книги в семье. Нормативы технической эксплуатации. Основы технической эксплуатации подвижного состава. Тема 8
Нормативы технической эксплуатации. Основы технической эксплуатации подвижного состава. Тема 8 Текущее содержание железнодорожного пути
Текущее содержание железнодорожного пути Маркировка и выбор абразивного инструмента
Маркировка и выбор абразивного инструмента Radars for various purposes
Radars for various purposes Торжественная линенйка, посвященная инаугурации президента школы
Торжественная линенйка, посвященная инаугурации президента школы Географический адрес объектов. Тест
Географический адрес объектов. Тест Презентация. Развитие связной речи. Тема Сластёна
Презентация. Развитие связной речи. Тема Сластёна Инновационные технологии для транспортного и инфраструктурного строительства с применением металлических конструкций
Инновационные технологии для транспортного и инфраструктурного строительства с применением металлических конструкций Птахівництво як галузь тваринництва
Птахівництво як галузь тваринництва