Содержание
- 2. Гетерогенные равновесия растворов с осадком [Ca2+], [CO32−] - равновесные концентрации ионов в растворе; [CaCO3] - концентрация
- 4. Связь между произведением растворимости и растворимостью осадка Обозначим молярную растворимость вещества через “S” . Тогда раствор
- 6. В присутствии одноименных ионов равновесие смещается в сторону образования осадка (эффект одноименного иона). AgNO3 Ag +
- 7. В присутствии сильных электролитов, не содержащих общих ионов, подвижность ионов в растворе уменьшается и равновесие смещается
- 9. Образование осадков - реакции обмена
- 10. Условие образования осадка: произведение концентраций ионов в растворе должно быть больше, чем величина произведения растворимости данного
- 17. ГИДРОЛИЗ СОЛЕЙ обменная реакция ионов соли с молекулами воды, приводящей к образованию молекул и ионов новых
- 19. Среда нейтральная, рН=7
- 24. Соль гидролизуется полностью и необратимо если она образована: - легколетучей или труднорастворимой кислотой (константа диссоциации не
- 25. Глубина гидролиза Показателем глубины протекания гидролиза является степень гидролиза. Глубина гидролиза зависит от соотношений значений константы
- 30. Гидролиз соли можно усилить также нагревая или разбавляя ее раствор. Гидролиз усиливается при нагревании. Гидролиз усиливается
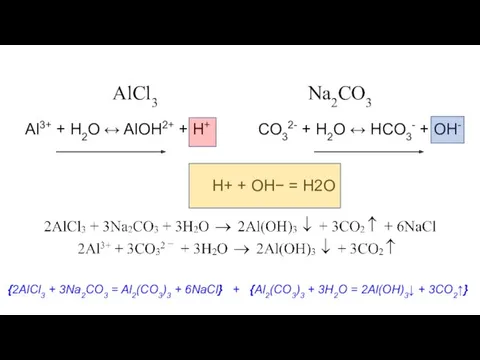
- 32. Al3+ + H2O ↔ AlOH2+ + H+ AlCl3 Na2CO3 CO32- + H2O ↔ HCO3- + OH-
- 33. В реакциях взаимного гидролиза в осадок выпадает наименее растворимый из возможных продуктов гидролиза.
- 35. Скачать презентацию
![Гетерогенные равновесия растворов с осадком [Ca2+], [CO32−] - равновесные концентрации](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/38606/slide-1.jpg)






























 Миома матки
Миома матки Психолингвистика
Психолингвистика презентация Волейбол
презентация Волейбол Компьютерная база данных моих документов
Компьютерная база данных моих документов Регистрация ЛС и лицензирования предприятия по их производству: требования к обеспечению качества в процессе производства
Регистрация ЛС и лицензирования предприятия по их производству: требования к обеспечению качества в процессе производства Требования к устройству и содержанию стрелочных переводов
Требования к устройству и содержанию стрелочных переводов Путешествие по Италии
Путешествие по Италии Православный храм
Православный храм La tomatina
La tomatina Особенности врачебного контроля женщин
Особенности врачебного контроля женщин Как колосок на стол пришёл
Как колосок на стол пришёл Расчет пневматической прессовой формовочной машины
Расчет пневматической прессовой формовочной машины 20231116_zadanie_8_oge
20231116_zadanie_8_oge Правовая ответственность врача. Права пациента. Чистота речи. Отношение к заимствованным словам. Канцеляризмы, речевые штампы
Правовая ответственность врача. Права пациента. Чистота речи. Отношение к заимствованным словам. Канцеляризмы, речевые штампы Виды корней. Типы корневых систем
Виды корней. Типы корневых систем Per aspera ad astra. Первые спутники
Per aspera ad astra. Первые спутники Австралия.
Австралия. Дизайн и архитектура моего сада. 7 класс
Дизайн и архитектура моего сада. 7 класс Презентация к методическому семинару Дискуссионные формы обучения в преподавании предметов как основа формирования глобального мышления.
Презентация к методическому семинару Дискуссионные формы обучения в преподавании предметов как основа формирования глобального мышления. Развитие телерадиовещания в Российской Федерации на 2009 – 2018 годы
Развитие телерадиовещания в Российской Федерации на 2009 – 2018 годы Вежливость
Вежливость Презентация Народный костюм
Презентация Народный костюм Что должен уметь ребенок 3-4 лет
Что должен уметь ребенок 3-4 лет Кофейная акварель
Кофейная акварель Сепсис. История
Сепсис. История Лекция 4 проектирование АТК. Расчет ленточных конвейеров
Лекция 4 проектирование АТК. Расчет ленточных конвейеров Родительское собрание
Родительское собрание Место и роль физической культуры в общей системе воспитания
Место и роль физической культуры в общей системе воспитания