Содержание
- 2. Определение Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или
- 3. Электролитическая диссоциация Электролиты и неэлектролиты Электролитическая диссоциация Механизм электролитической диссоциации Сильные и слабые электролиты Диссоциация кислот,
- 4. Электролитическая диссоциация химических элементов Основные положения теории: 1. Электролиты при растворении в воде распадаются (диссоциируют) на
- 5. Основные положения теории: 2. При действии электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся
- 6. Основные положения теории: 3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциацией) протекает
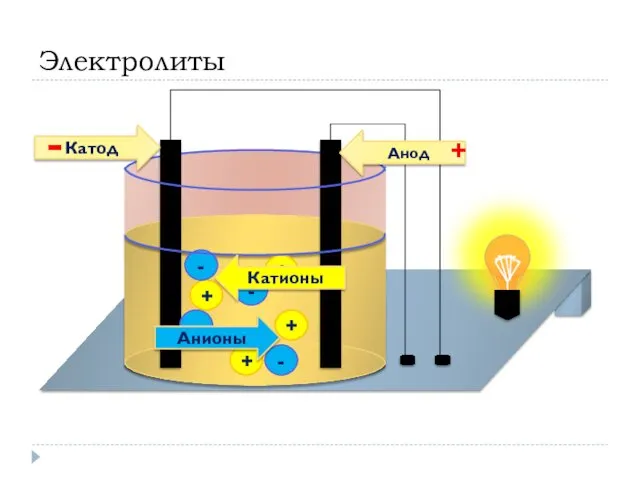
- 7. Электролиты Электролиты- это вещества, растворы и расплавы которых проводят электический ток. Кислоты Щелочи Соли HCl; HNO3;
- 8. Электролиты + + + + - - - - Анионы Катионы Анод Катод - +
- 9. Неэлектролиты Неэлектролиты- это вещества, растворы или расплавы которых не проводят электрический ток. Органический вещества: сахар, ацетон,
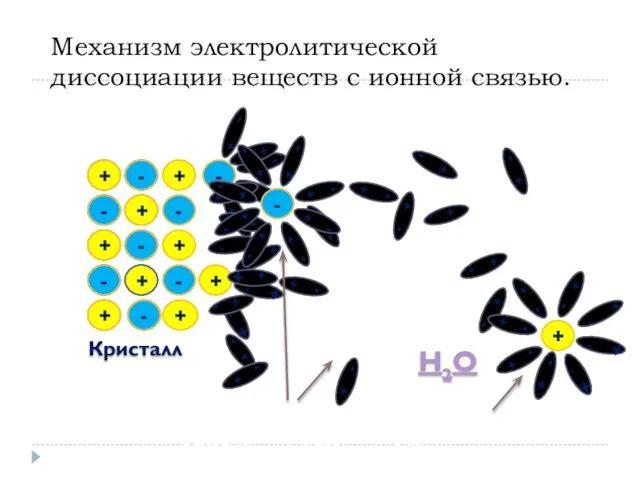
- 10. Механизм электролитической диссоциации веществ с ионной связью. + + - - + + - - Кристалл
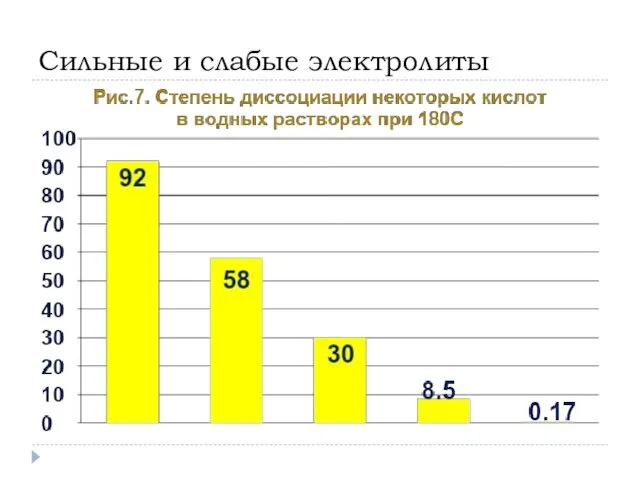
- 11. Степень электролитической диссоциации (α) - отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе.
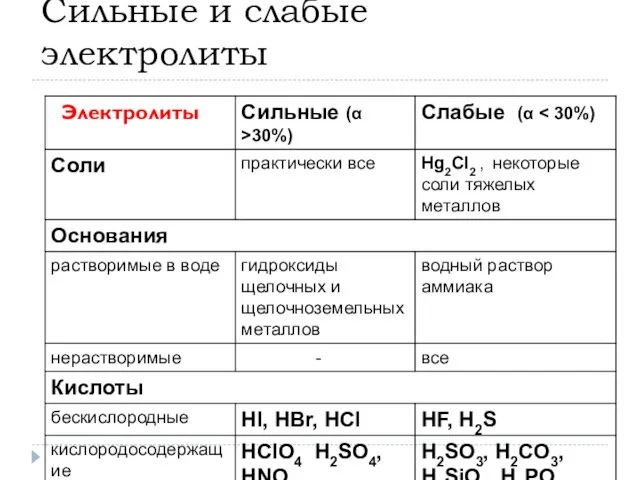
- 12. Сильные и слабые электролиты Электролиты
- 13. Сильные и слабые электролиты
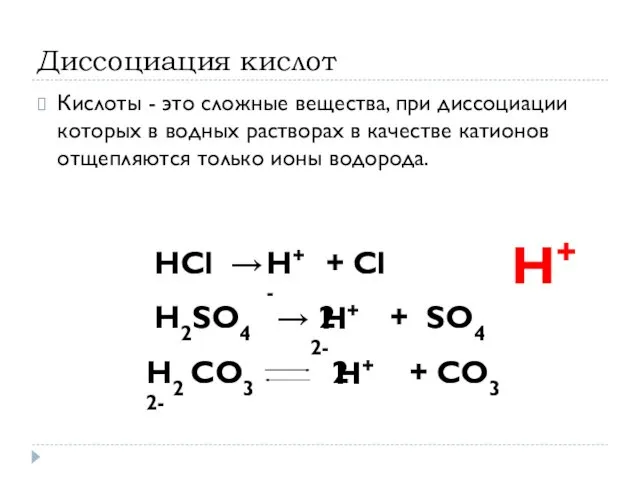
- 14. Диссоциация кислот Кислоты - это сложные вещества, при диссоциации которых в водных растворах в качестве катионов
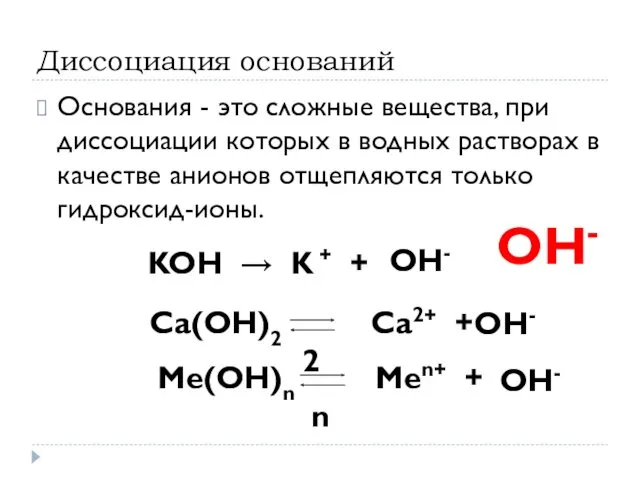
- 15. Диссоциация оснований Основания - это сложные вещества, при диссоциации которых в водных растворах в качестве анионов
- 16. Диссоциация солей Соли- это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы
- 17. Электролитическая диссоциация Электролиты – составная часть жидкостей и плотных тканей живых организмов. Ионы Na+,K+,Ca2+,Mg2+,H+; OH-; Cl-;
- 18. Закон разбавления Оствальда K=a2C 1-a здесь C-молярная концентрация электролита, моль/л.Если степень диссоциации значительно меньше единицы, то
- 20. Скачать презентацию











 Мертвое море
Мертвое море Формирование просодической стороны речи у детей с дизартрией.
Формирование просодической стороны речи у детей с дизартрией. Россия на карте часовых поясов
Россия на карте часовых поясов Общее лечение кариеса зубов
Общее лечение кариеса зубов Ваши права (презентация к классному часу)
Ваши права (презентация к классному часу) Cerberus Mouse FW update SOP
Cerberus Mouse FW update SOP Электролиз. Электроды
Электролиз. Электроды Творческий проект Парусная лодка
Творческий проект Парусная лодка 20240119_prezentatsiya-po-professionalno-trudovomu-obucheniyu
20240119_prezentatsiya-po-professionalno-trudovomu-obucheniyu Сказка Волшебный колокольчикпрезентация на новый год.
Сказка Волшебный колокольчикпрезентация на новый год. В семье первоклассник
В семье первоклассник Детское экспериментирование претендует на роль ведущей деятельности в период дошкольного развития.
Детское экспериментирование претендует на роль ведущей деятельности в период дошкольного развития. Сумма векторов
Сумма векторов Обобщающий урок по теме: Геометрические фигуры
Обобщающий урок по теме: Геометрические фигуры Презентация День Защитника Отечества.
Презентация День Защитника Отечества. Город будущего
Город будущего Царство растений
Царство растений Фонд скважин при разработке месторождения
Фонд скважин при разработке месторождения Apparel textiles. Homes textile. Technical textiles
Apparel textiles. Homes textile. Technical textiles Переоборудование железнодорожного транспорта на газодизельный цикл
Переоборудование железнодорожного транспорта на газодизельный цикл Национальные религии. Синтоизм
Национальные религии. Синтоизм Гиперпаратиреоз. Фракции Са плазмы крови
Гиперпаратиреоз. Фракции Са плазмы крови Использование здоровьесберегающих технологий в начальной школе
Использование здоровьесберегающих технологий в начальной школе Большая пятёрка как методологическая основа психологической оценки персонала
Большая пятёрка как методологическая основа психологической оценки персонала Центрсвет. Мы сфокусированы на разработке и производстве светильников применимых в разных сферах жизни
Центрсвет. Мы сфокусированы на разработке и производстве светильников применимых в разных сферах жизни Презентация Что за прелесть эти сказки Что за прелесть эти сказки!
Презентация Что за прелесть эти сказки Что за прелесть эти сказки! The world’s architecture of the 1960’s
The world’s architecture of the 1960’s Полупустыни и пустыни
Полупустыни и пустыни