Содержание
- 2. Уравнение состояния идеального газа Д.И.Менделеев Клапейрон Бэнуа
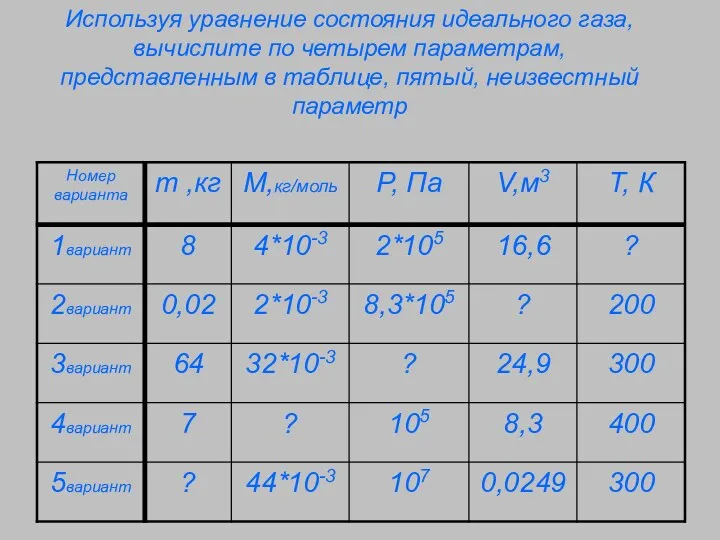
- 3. Используя уравнение состояния идеального газа, вычислите по четырем параметрам, представленным в таблице, пятый, неизвестный параметр
- 4. С помощью Уравнения состояния идеального газа можно исследовать процессы, в которых при постоянной массе один из
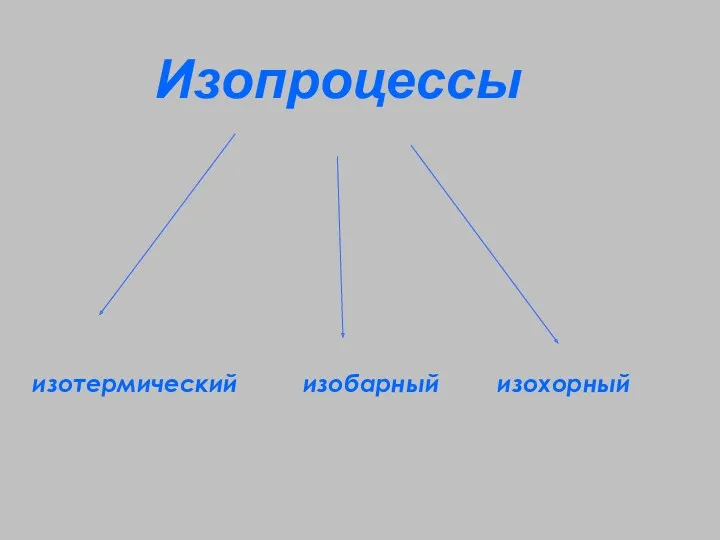
- 5. Изопроцессы – процессы, протекающие при неизменном значении одного из параметров “изо” - постоянство
- 6. Изопроцессы изотермический изобарный изохорный
- 7. PV= m M R T
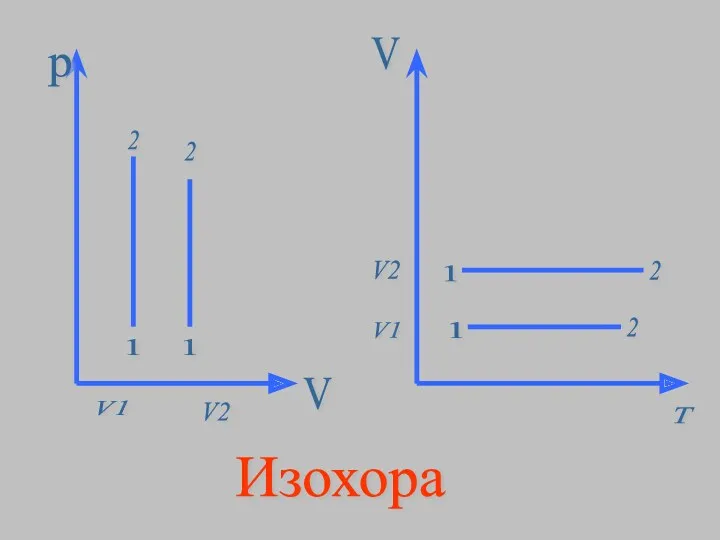
- 8. Изохорный процесс - процесс изменения состояния термодинамической системы протекающий при постоянном объёме. (от греческих слов isos-
- 9. модель
- 10. 1787 г. Ж. Шарль французский физик экспериментальным путём исследовал зависимость давления газа от температуры.
- 11. Вывод закона для изохорного процесса PV=mRT/M - уравнение Менделеева-Клапейрона при m=const и V=const получаем уравнение: Закон
- 12. р1/T1 = р2/Т2 Для газа данной массы отношение давления к температуре остаётся постоянным при неизменном объёме.
- 13. V1 p T V2 1 2 1 2 Изохора График изохорного процесса
- 14. p V V2 V1 1 2 1 2 V T V1 V2 1 2 1 2
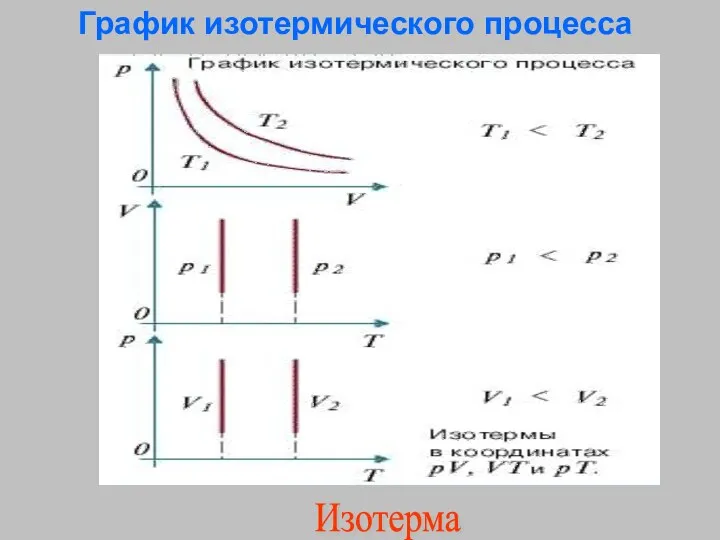
- 15. Изотермический процесс – процесс изменения состояния термодинамической системы протекающий при постоянной температуре (от греческих слов isos-
- 16. модель
- 17. 1662 г. из эксперимента было получено Р. Бойлем (английским учёным) уравнение, устанавливающее связь между давлением и
- 18. Вывод закона для изотермического процесса pave = mRT/μ – закон Менделеева-Клапейрона при m=const и Т=const, получаем
- 19. закон Бойля-Мариотта р1V1 = р2V2 Для газа данной массы произведение давления газа на его объём остаётся
- 20. График изотермического процесса Изотерма
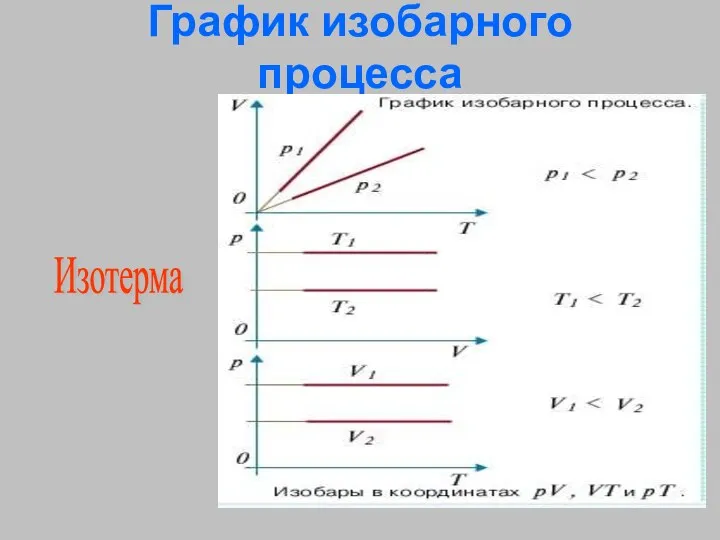
- 21. Изобарный процесс - процесс изменения состояния термодинамической системы протекающий при постоянном давлении. (от греческих слов isos-
- 22. модель
- 23. 1802 г. французский физик Ж. Гей-Люссак провел экспериментальное исследование зависимости объёма газа от температуры. Жозеф Луи
- 24. Вывод закона для изобарного процесса PV=mRT/μ - уравнение Менделеева-Клапейрона при m=const и р=const, получаем уравнение: Закон
- 25. Закон Гей-Люссака V1/Т1 = V2/T2 – Для газа данной массы отношение объёма газа и его температуры
- 26. График изобарного процесса Изотерма
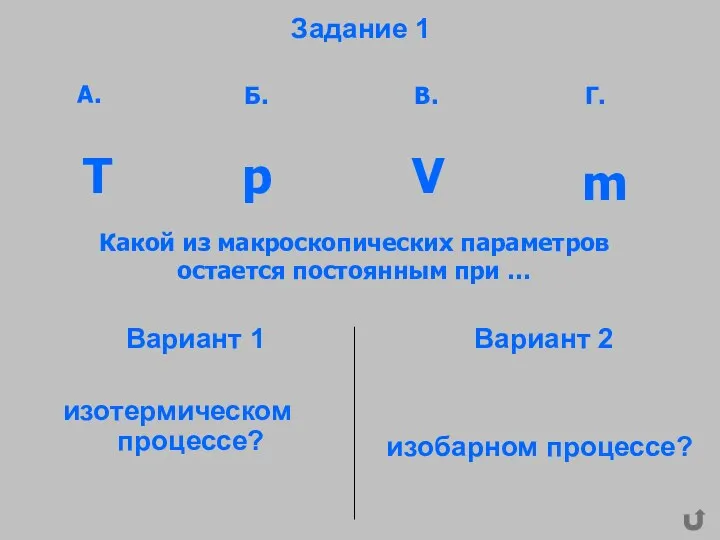
- 27. Задание 1 Вариант 1 изотермическом процессе? Вариант 2 изобарном процессе? Какой из макроскопических параметров остается постоянным
- 28. Задание 2 Какая из формул описывает закон Вариант 1 Вариант 2 Бойля-Мариотта? Гей-Люссака?
- 30. Задание 4 Какой график соответствует Вариант 1 изохорному процессу? Вариант 2 изотермическому процессу?
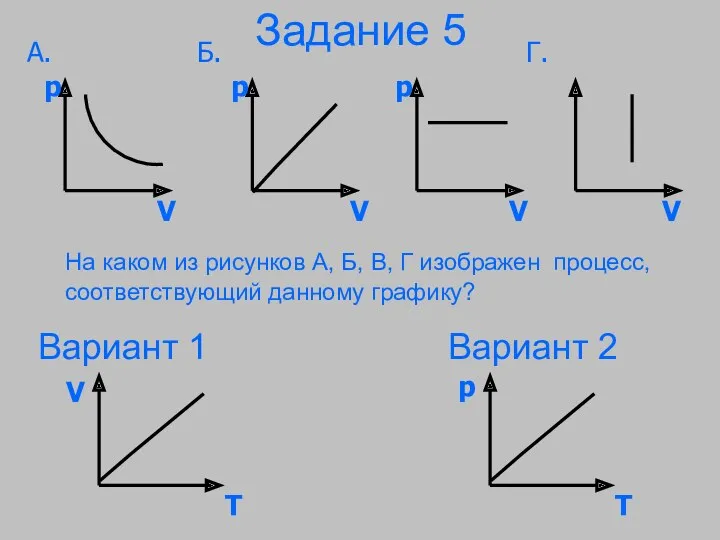
- 31. Задание 5 На каком из рисунков А, Б, В, Г изображен процесс, соответствующий данному графику? Вариант
- 33. Скачать презентацию



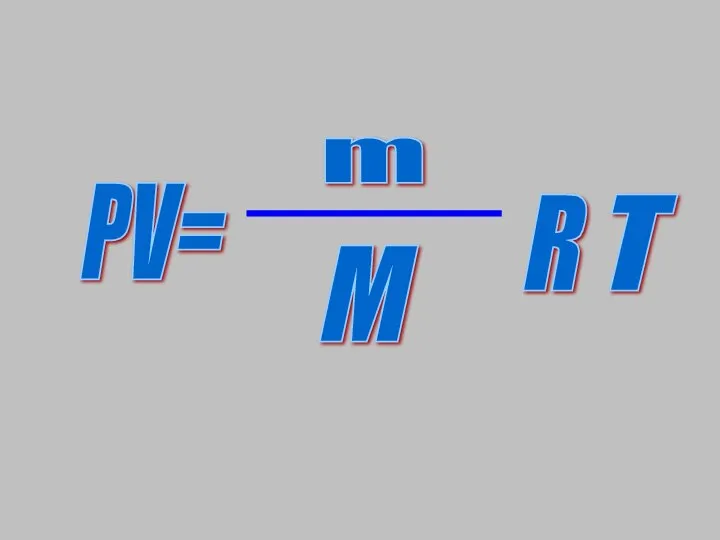



















 Презентация к уроку физики Первый закон термодинамики
Презентация к уроку физики Первый закон термодинамики Потенциал. Решение задач
Потенциал. Решение задач Молекулярная физика. Молекулярно-кинетическая теория. Масса и размеры молекул
Молекулярная физика. Молекулярно-кинетическая теория. Масса и размеры молекул Определение элементного состава вещества методом рентгенофлуоресцентной спектроскопии
Определение элементного состава вещества методом рентгенофлуоресцентной спектроскопии Теоретическая механика. Кинематика. Курс лекций
Теоретическая механика. Кинематика. Курс лекций Виды спектров
Виды спектров Класифікація плугів. Класифікація фрез. Лекція 3
Класифікація плугів. Класифікація фрез. Лекція 3 Положительные лучи. Определение истинных масс атомов. Изотопы. АФ1.5
Положительные лучи. Определение истинных масс атомов. Изотопы. АФ1.5 Зат құрылысының атомдық теориясы
Зат құрылысының атомдық теориясы Детекторы ионизирующих излучений. Сцинтилляционные методы детектирования ионизирующих излучений
Детекторы ионизирующих излучений. Сцинтилляционные методы детектирования ионизирующих излучений Теорема об изменении импульса механической системы
Теорема об изменении импульса механической системы Работа и мощность электрического тока. Единицы работы электрического тока
Работа и мощность электрического тока. Единицы работы электрического тока Основы слесарно-сборочных и электромонтажных работ. Резка
Основы слесарно-сборочных и электромонтажных работ. Резка Физико-технические основы электроэнергетики. Лекция 11
Физико-технические основы электроэнергетики. Лекция 11 Импульс тела. Закон сохранения
Импульс тела. Закон сохранения Температура
Температура Урок по теме Квантовые постулаты Бора, 11 класс
Урок по теме Квантовые постулаты Бора, 11 класс Сложные электрические цепи
Сложные электрические цепи Общие свойства ионизирующих излучений ядерного взрыва
Общие свойства ионизирующих излучений ядерного взрыва Средства конвективного нагрева
Средства конвективного нагрева Проявление сил тяжести и упругости живой природе
Проявление сил тяжести и упругости живой природе Терморазведка. Тепловое поле
Терморазведка. Тепловое поле Nucleul atomic
Nucleul atomic Гироскопические приборы и устройства. (Модуль 2.7)
Гироскопические приборы и устройства. (Модуль 2.7) Сұйықтардың беттік керілуі
Сұйықтардың беттік керілуі Расчет количества теплоты, необходимого для нагревания тела или выделяемого им при охлаждении
Расчет количества теплоты, необходимого для нагревания тела или выделяемого им при охлаждении Принципы радиосвязи
Принципы радиосвязи Механические колебания. Кинематика и динамика колебательного движения
Механические колебания. Кинематика и динамика колебательного движения