Содержание
- 2. СОЗДАТЕЛИ АТОМНОЙ ТЕОРИИ Джон Дмитрий Дальтон Менделеев Амедео Эрнест Авогадро Резерфорд
- 3. Основные положения МКТ • Все тела состоят из малых частиц, между которыми есть промежутки. • Частицы
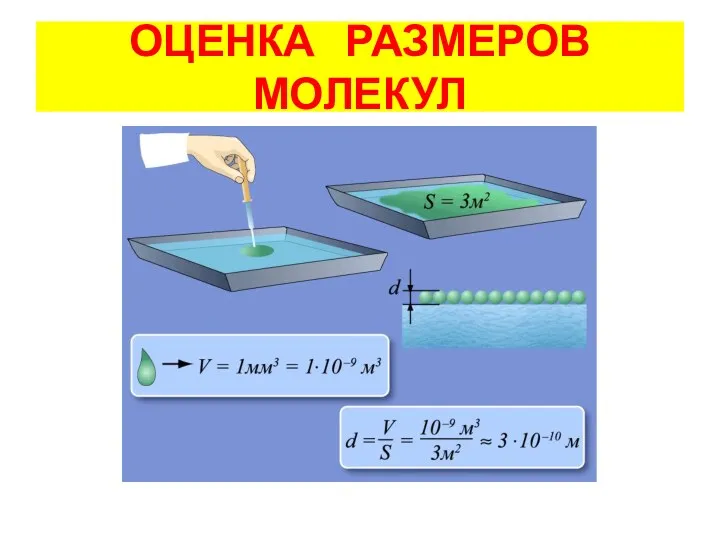
- 4. ОЦЕНКА РАЗМЕРОВ МОЛЕКУЛ
- 5. КОЛИЧЕСТВО ВЕЩЕСТВА В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется
- 6. ФОРМУЛЫ
- 7. В одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется
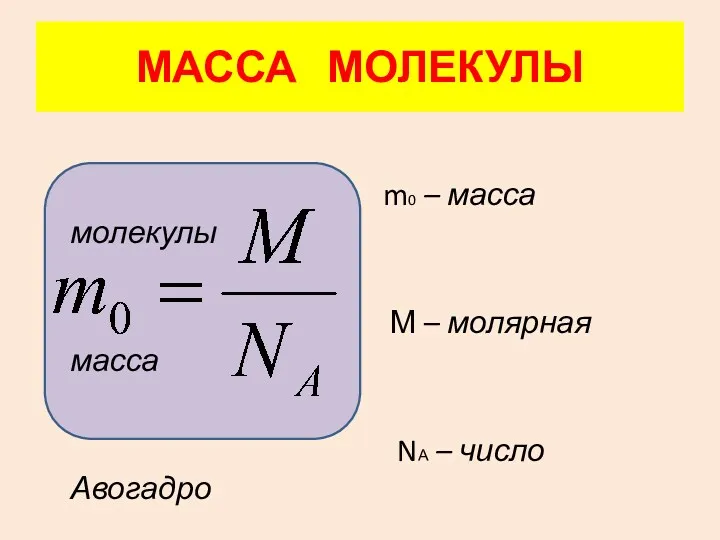
- 8. МАССА МОЛЕКУЛЫ m0 – масса молекулы М – молярная масса NА – число Авогадро
- 9. ЗАДАЧИ 1. Рассчитать массу молекулы Н2SО4. М(Н2SО4) = 2·1 + 32 + 16·4 = 98 г/моль
- 11. Скачать презентацию






 Презентация к уроку физики Первый закон термодинамики
Презентация к уроку физики Первый закон термодинамики Потенциал. Решение задач
Потенциал. Решение задач Молекулярная физика. Молекулярно-кинетическая теория. Масса и размеры молекул
Молекулярная физика. Молекулярно-кинетическая теория. Масса и размеры молекул Определение элементного состава вещества методом рентгенофлуоресцентной спектроскопии
Определение элементного состава вещества методом рентгенофлуоресцентной спектроскопии Теоретическая механика. Кинематика. Курс лекций
Теоретическая механика. Кинематика. Курс лекций Виды спектров
Виды спектров Класифікація плугів. Класифікація фрез. Лекція 3
Класифікація плугів. Класифікація фрез. Лекція 3 Положительные лучи. Определение истинных масс атомов. Изотопы. АФ1.5
Положительные лучи. Определение истинных масс атомов. Изотопы. АФ1.5 Зат құрылысының атомдық теориясы
Зат құрылысының атомдық теориясы Детекторы ионизирующих излучений. Сцинтилляционные методы детектирования ионизирующих излучений
Детекторы ионизирующих излучений. Сцинтилляционные методы детектирования ионизирующих излучений Теорема об изменении импульса механической системы
Теорема об изменении импульса механической системы Работа и мощность электрического тока. Единицы работы электрического тока
Работа и мощность электрического тока. Единицы работы электрического тока Основы слесарно-сборочных и электромонтажных работ. Резка
Основы слесарно-сборочных и электромонтажных работ. Резка Физико-технические основы электроэнергетики. Лекция 11
Физико-технические основы электроэнергетики. Лекция 11 Импульс тела. Закон сохранения
Импульс тела. Закон сохранения Температура
Температура Урок по теме Квантовые постулаты Бора, 11 класс
Урок по теме Квантовые постулаты Бора, 11 класс Сложные электрические цепи
Сложные электрические цепи Общие свойства ионизирующих излучений ядерного взрыва
Общие свойства ионизирующих излучений ядерного взрыва Средства конвективного нагрева
Средства конвективного нагрева Проявление сил тяжести и упругости живой природе
Проявление сил тяжести и упругости живой природе Терморазведка. Тепловое поле
Терморазведка. Тепловое поле Nucleul atomic
Nucleul atomic Гироскопические приборы и устройства. (Модуль 2.7)
Гироскопические приборы и устройства. (Модуль 2.7) Сұйықтардың беттік керілуі
Сұйықтардың беттік керілуі Расчет количества теплоты, необходимого для нагревания тела или выделяемого им при охлаждении
Расчет количества теплоты, необходимого для нагревания тела или выделяемого им при охлаждении Принципы радиосвязи
Принципы радиосвязи Механические колебания. Кинематика и динамика колебательного движения
Механические колебания. Кинематика и динамика колебательного движения