Содержание
- 2. 2.1 Кривая Морзе. Основные параметры химической связи rсв[Å] - длина химической связи Eсв[эВ, кДж/моль] - энергия
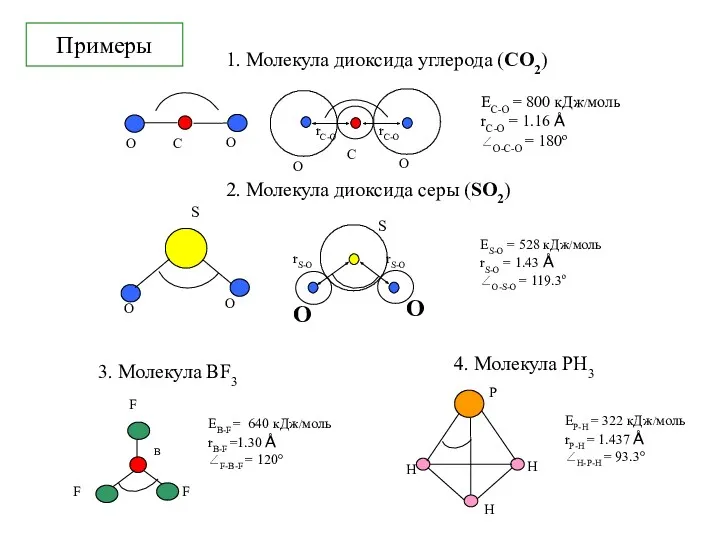
- 3. Примеры
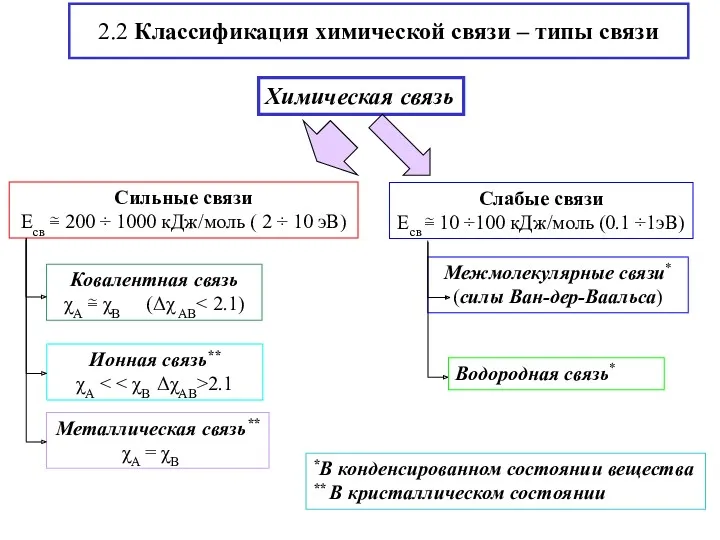
- 4. 2.2 Классификация химической связи – типы связи Химическая связь *В конденсированном состоянии вещества ** В кристаллическом
- 5. 2.3 Ковалентная хим.связь Количественное квантово-механическое описание связи - это определение параметров связи ( Eсв , rсв
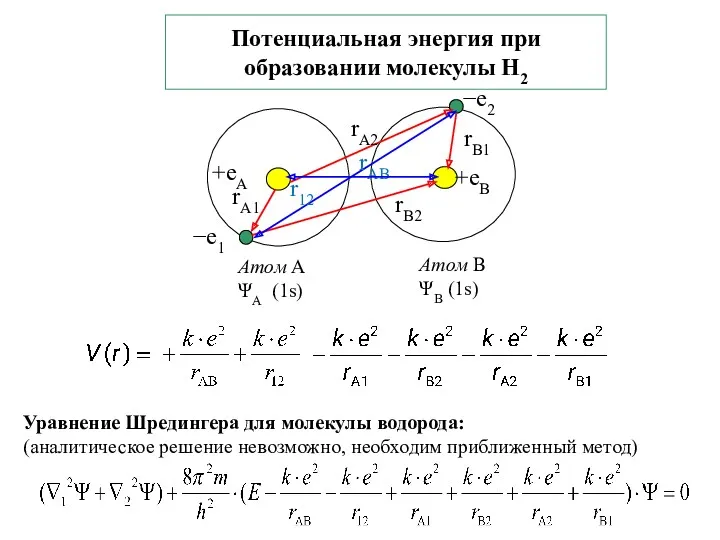
- 6. Потенциальная энергия при образовании молекулы Н2
- 7. Метод валентных связей (ВС) (на примере молекулы Н2) В.Гайтлер и Ф.Лондон 1927 г. Принимается: 1) Атомы
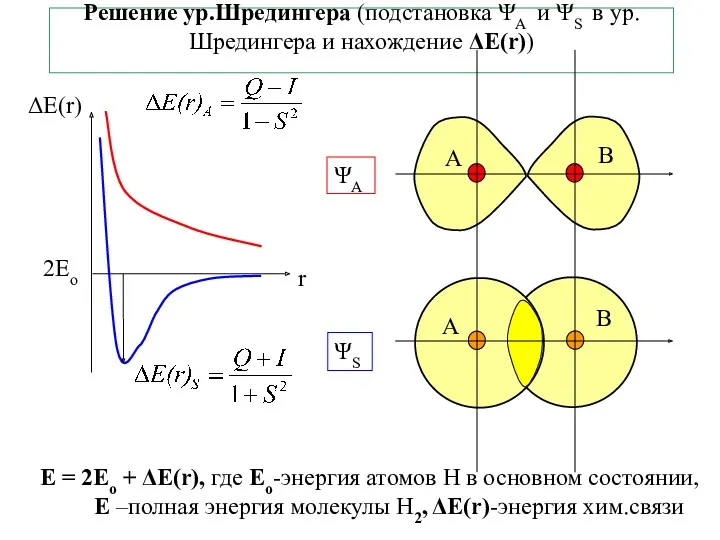
- 8. Решение ур.Шредингера (подстановка ΨА и ΨS в ур.Шредингера и нахождение ΔЕ(r)) Е = 2Ео + ΔЕ(r),
- 9. Интегралы ψi2dV – вероятность i -электрона; q = e⋅ψi2dV - заряд I –“обменный интеграл”-∆Е вследствие неразличимости
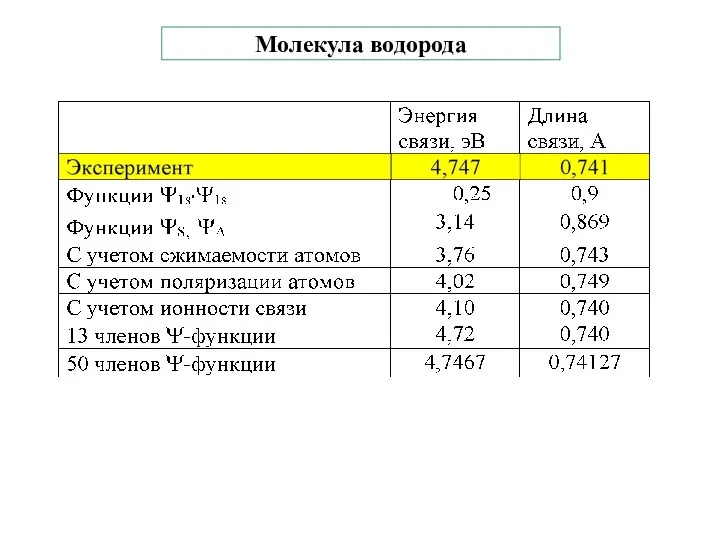
- 10. Молекула водорода
- 11. Принципы (постулаты) метода ВС(на основе представлений при расчете молекулы водорода) 1) Единичная химическая связь образуется общей
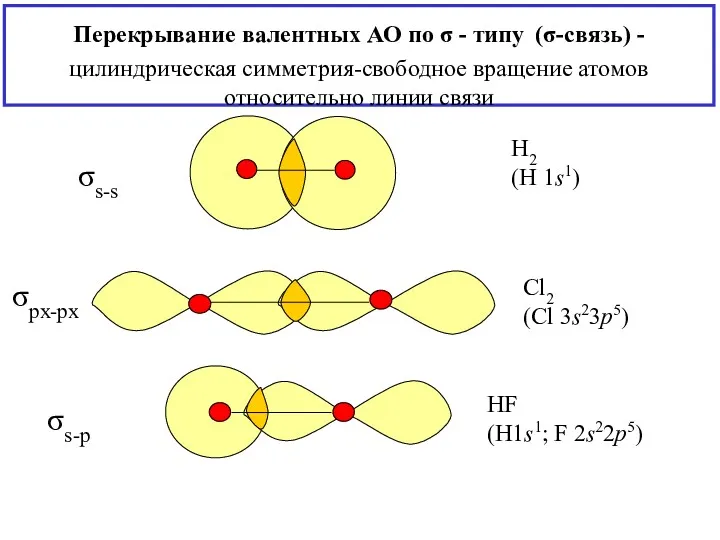
- 12. Перекрывание валентных АО по σ - типу (σ-связь) - цилиндрическая симметрия-свободное вращение атомов относительно линии связи
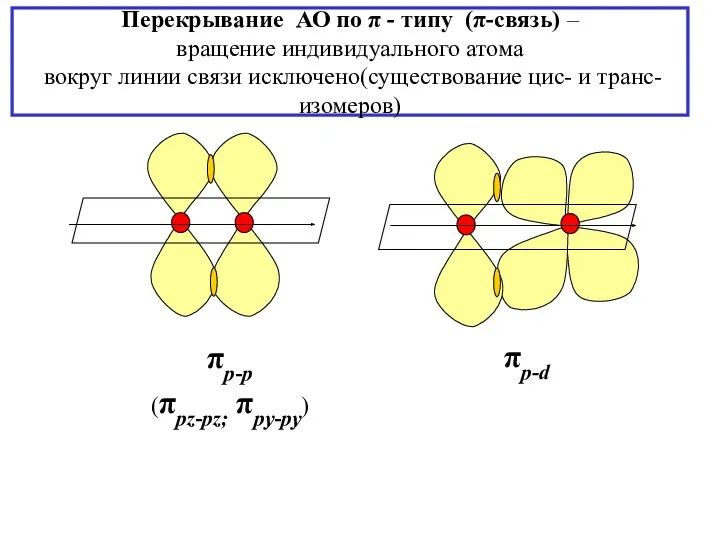
- 13. Перекрывание АО по π - типу (π-связь) – вращение индивидуального атома вокруг линии связи исключено(существование цис-
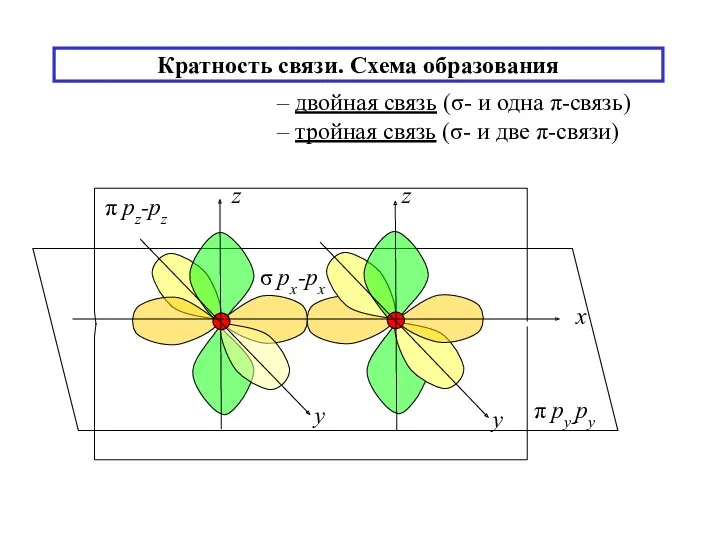
- 14. Кратность связи. Схема образования – двойная связь (σ- и одна π-связь) – тройная связь (σ- и
- 15. Примеры
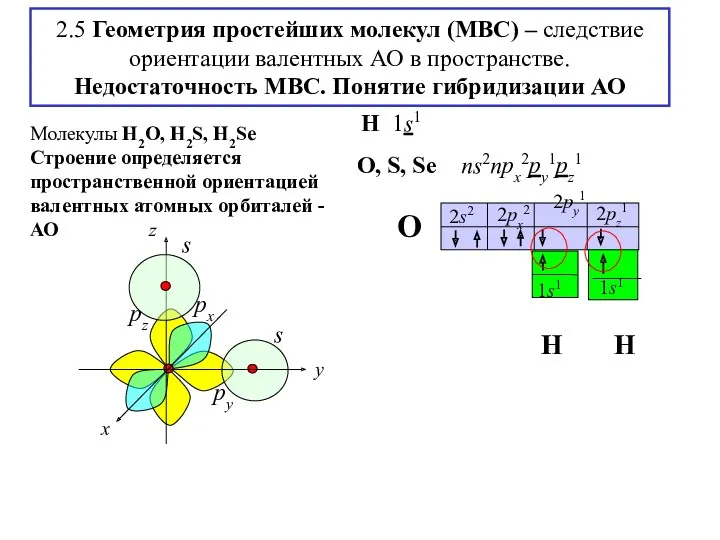
- 16. 2.5 Геометрия простейших молекул (МВС) – следствие ориентации валентных АО в пространстве. Недостаточность МВС. Понятие гибридизации
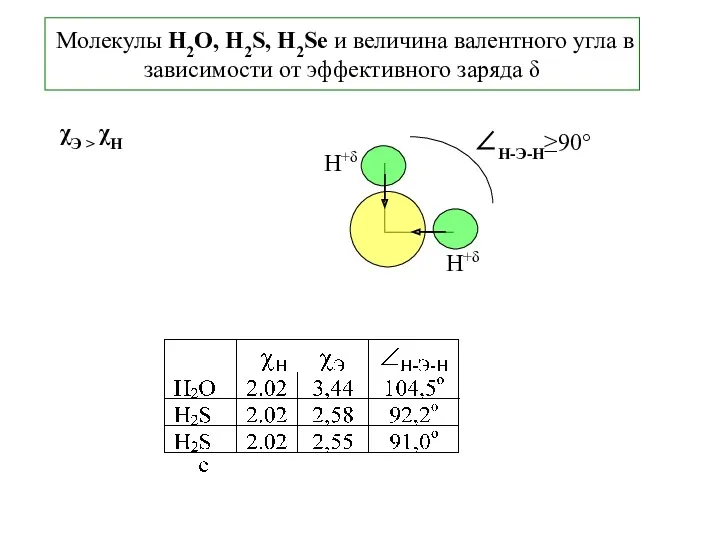
- 17. Молекулы H2O, H2S, H2Se и величина валентного угла в зависимости от эффективного заряда δ χЭ >
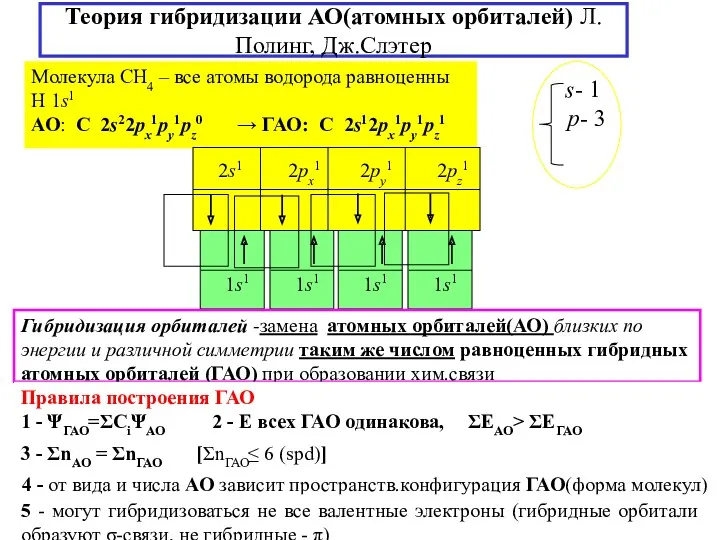
- 18. Теория гибридизации АО(атомных орбиталей) Л.Полинг, Дж.Слэтер Молекула СH4 – все атомы водорода равноценны H 1s1 АО:
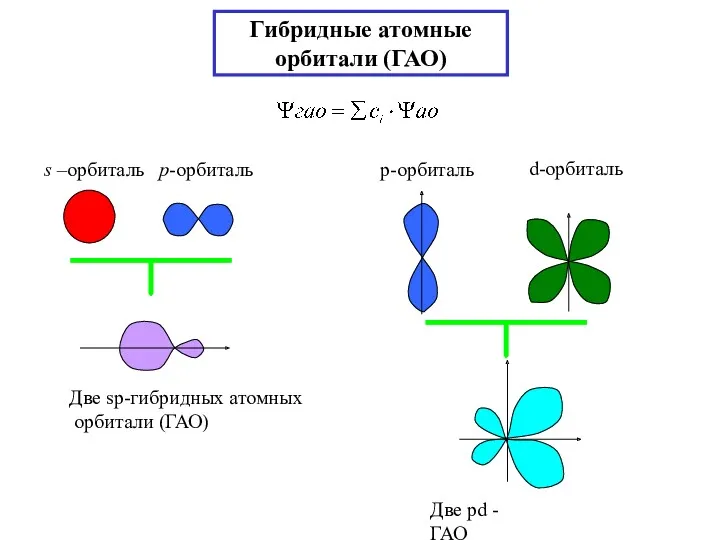
- 19. Гибридные атомные орбитали (ГАО)
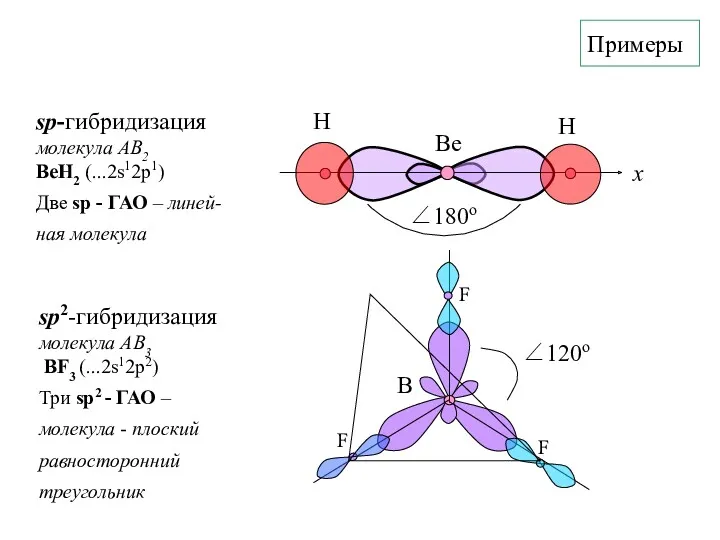
- 20. Примеры sp-гибридизация молекула АВ2 BeH2 (...2s12p1) Две sp - ГАО – линей- ная молекула sp2-гибридизация молекула
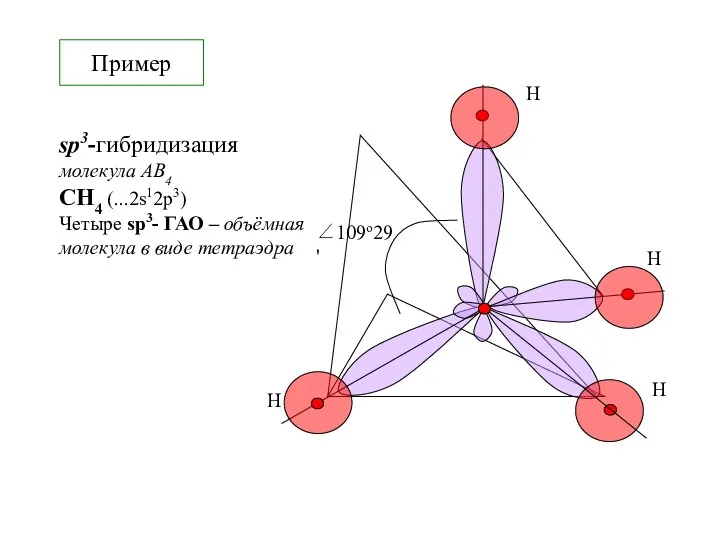
- 21. Пример sp3-гибридизация молекула АВ4 СH4 (...2s12p3) Четыре sp3- ГАО – объёмная молекула в виде тетраэдра
- 22. Пример dsp2-гибридизация молекулярный ион [CuCl4]-2 плоский квадрат Cu
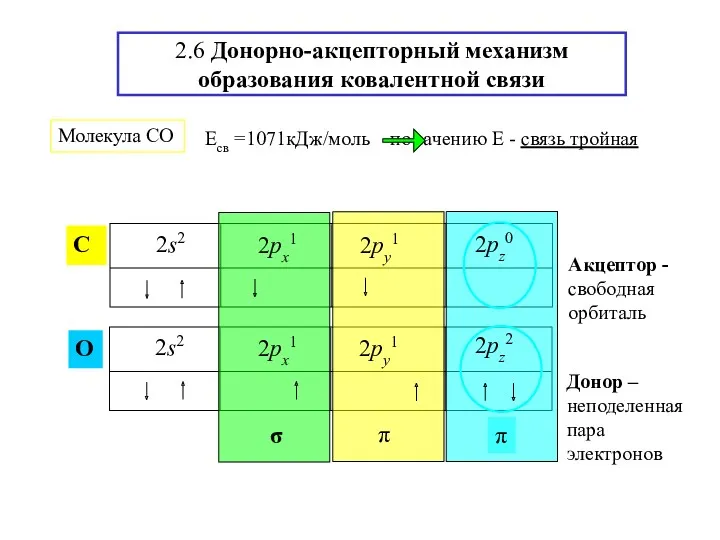
- 23. 2.6 Донорно-акцепторный механизм образования ковалентной связи Молекула СО
- 24. Ион [NH4]+ NH3 + H+ → [NH4]+ Из эксперимента - четыре равноценных атома водорода, тетраэдрическая конфигурация
- 25. 2.7 Метод молекулярных орбиталей (ММО) Роберт Малликен Принимается: 1.Каждый электрон в молекуле движется в результирующем поле
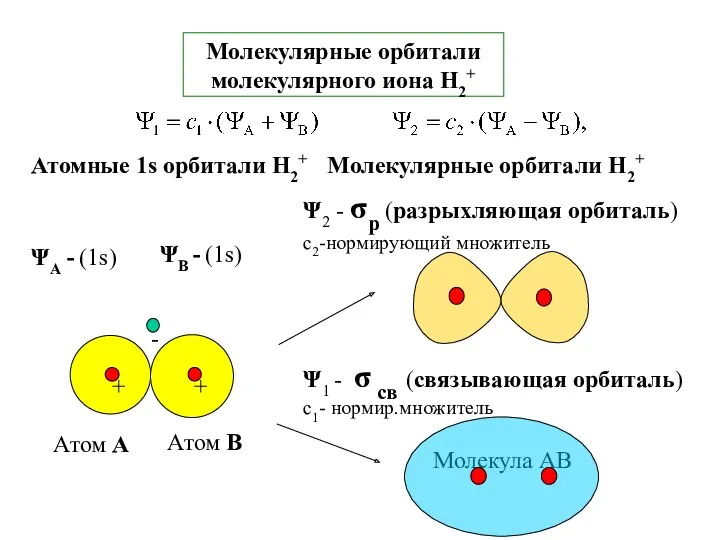
- 26. Молекулярные орбитали молекулярного иона Н2+ -
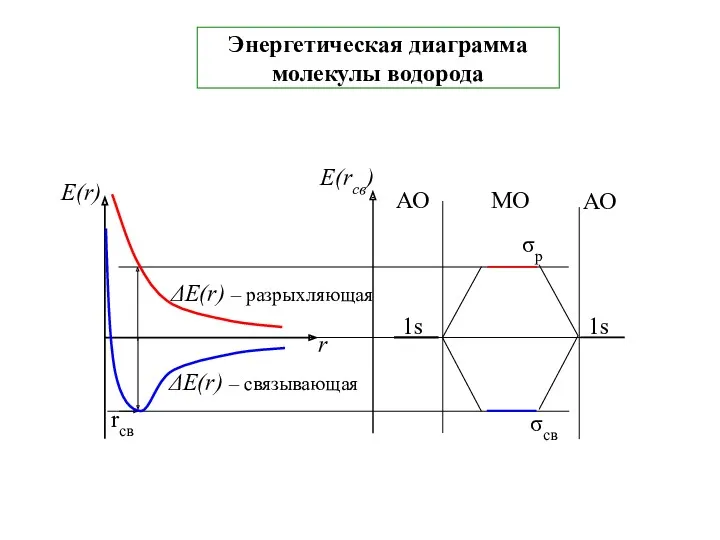
- 27. Энергетическая диаграмма молекулы водорода
- 28. Правила построения энергетических диаграмм ММО 1. Выбираются АО изолированных атомов, принимающие участие в образовании химической связи
- 30. Скачать презентацию
![2.1 Кривая Морзе. Основные параметры химической связи rсв[Å] - длина](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/207727/slide-1.jpg)





![Пример dsp2-гибридизация молекулярный ион [CuCl4]-2 плоский квадрат Cu](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/207727/slide-21.jpg)
![Ион [NH4]+ NH3 + H+ → [NH4]+ Из эксперимента -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/207727/slide-23.jpg)


 Классификация химических реакций
Классификация химических реакций Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5
Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5 Виды химической связи
Виды химической связи Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Основные виды химических связей
Основные виды химических связей Композиты как материалы конструкционного назначения
Композиты как материалы конструкционного назначения Чистые вещества и смеси
Чистые вещества и смеси Геохимическая классификация элементов
Геохимическая классификация элементов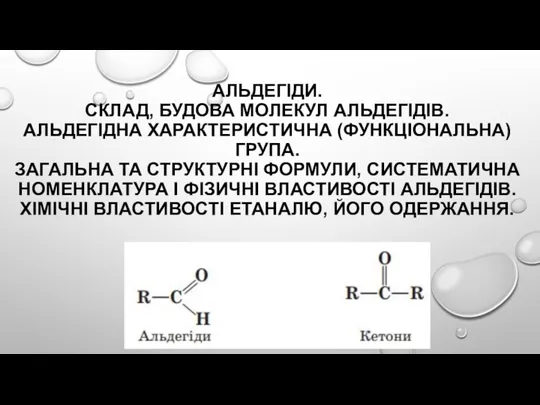 Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Тепловой эффект химической реакции
Тепловой эффект химической реакции Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Водород. Положение в периодической системе
Водород. Положение в периодической системе Основные виды химических связей
Основные виды химических связей Центрифугирование в почвоведении
Центрифугирование в почвоведении Нахождение металлов в природе. Общие способы получения металлов. 9 класс
Нахождение металлов в природе. Общие способы получения металлов. 9 класс Химия нефти и газа
Химия нефти и газа Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары
Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары Генетическая связь между классами неорганических веществ. Химический тренажёр
Генетическая связь между классами неорганических веществ. Химический тренажёр Түсті металдар
Түсті металдар Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Типы химических реакций в органической химии
Типы химических реакций в органической химии Трансмиссионные масла
Трансмиссионные масла Тепловой эффект химических реакций
Тепловой эффект химических реакций Титриметрический метод анализа
Титриметрический метод анализа Синтетические моющие средства. Использование их в повседневной жизни
Синтетические моющие средства. Использование их в повседневной жизни Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Общие способы получения металлов
Общие способы получения металлов Алкадиены
Алкадиены