Содержание
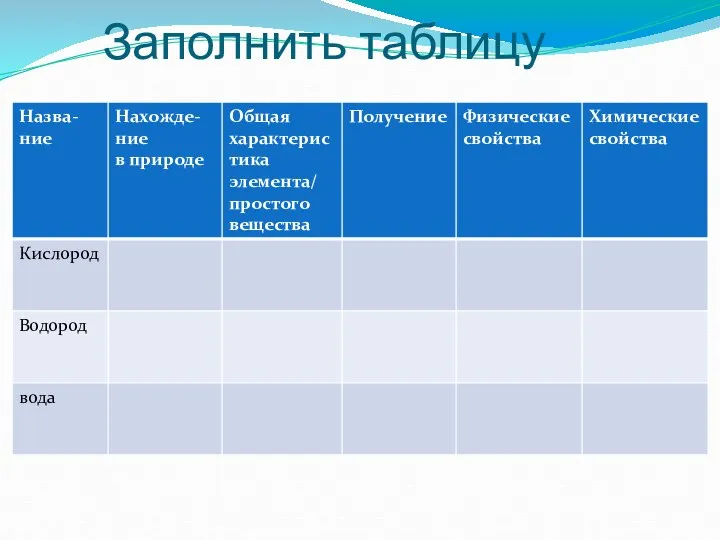
- 2. Заполнить таблицу
- 3. Кислород Химия 8 класс
- 4. План Общая характеристика Нахождение в природе История открытия Физические свойства Получение
- 5. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТА «КИСЛОРОД» Химический знак Положение в ПСХЭ (указать период, группа, порядковый номер) Относительная атомная
- 6. Химический знак - О Положение в ПСХЭ период II, группа VIА, порядковый номер 8 Относительная атомная
- 7. Кислород как элемент В земной коре его 49% по массе, в гидросфере – 89% по массе.
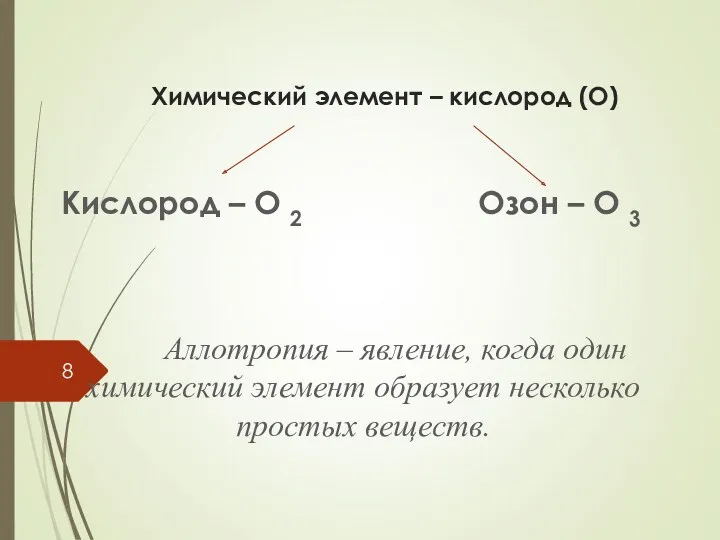
- 8. Химический элемент – кислород (О) Кислород – О 2 Озон – О 3 Аллотропия – явление,
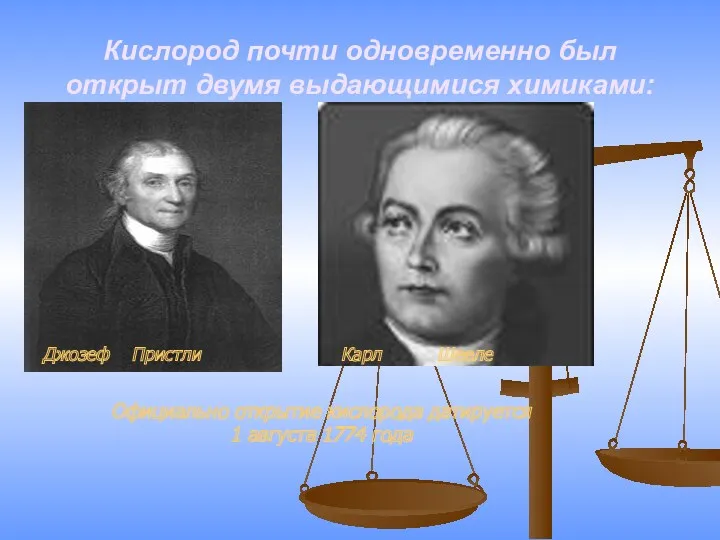
- 9. Кислород почти одновременно был открыт двумя выдающимися химиками: Джозеф Пристли Карл Шееле Официально открытие кислорода датируется
- 10. оксюс – «кислый» генао – «рождаю» Современное название кислороду дал Антуан Лавуазье
- 11. Физические свойства Газ - без цвета, вкуса и запаха; мало растворим в воде t°кип= -183°С; t°пл
- 12. Получение кислорода В лаборатории кислород чаще всего получают из перманганата калия (KMnO4), пероксида водорода (H2O2) и
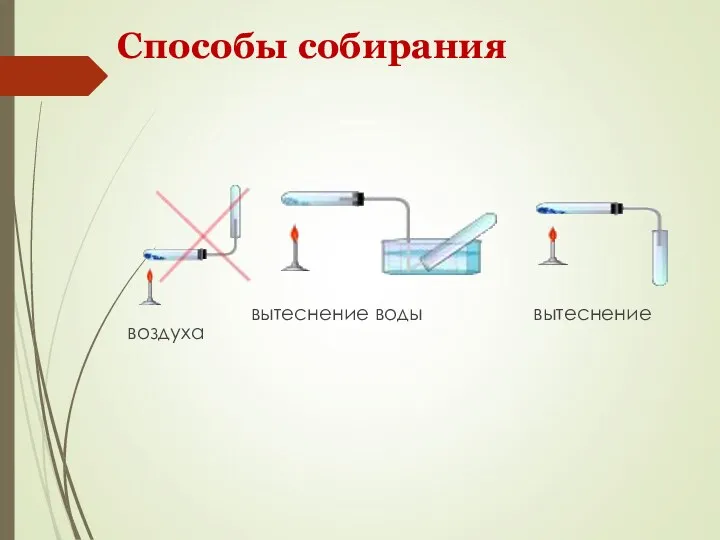
- 13. Способы собирания вытеснение воды вытеснение воздуха
- 14. Взаимодействие веществ с кислородом называется окислением. С кислородом реагируют все элементы, кроме Au, Pt, He, Ne
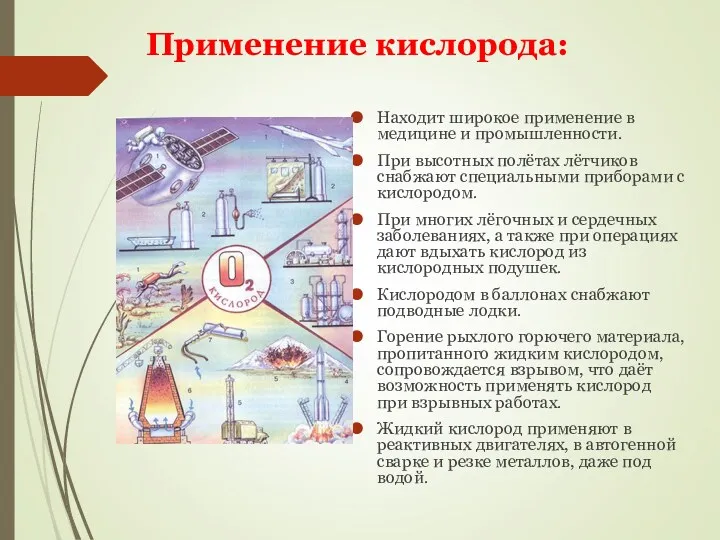
- 15. Находит широкое применение в медицине и промышленности. При высотных полётах лётчиков снабжают специальными приборами с кислородом.
- 16. По горизонтали: 1. Без него невозможно дышать 4. Химическая реакция, при которой происходит окисление веществ с
- 18. Скачать презентацию










 Натуральный и синтетический каучуки. Резина
Натуральный и синтетический каучуки. Резина Кислотно-основные (протолитические) равновесия
Кислотно-основные (протолитические) равновесия Основания (3)
Основания (3) Нафталин
Нафталин Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Химическая связь
Химическая связь AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі
AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі Подземное хранение газа и жидкости
Подземное хранение газа и жидкости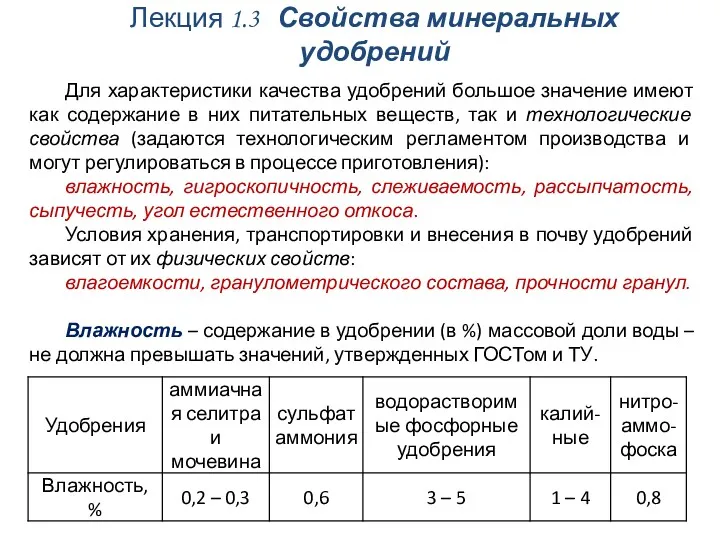 Свойства минеральных удобрений
Свойства минеральных удобрений Химическая кинетика
Химическая кинетика Классификация и свойства кислот
Классификация и свойства кислот Виведення формул органічних сполук за масовими частками елементів
Виведення формул органічних сполук за масовими частками елементів Полудрагоценные камни
Полудрагоценные камни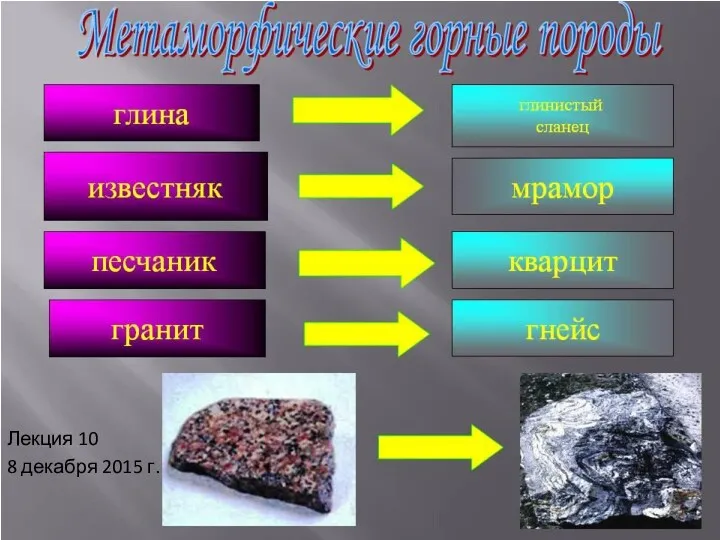 Метаморфические породы. (Лекция 10)
Метаморфические породы. (Лекция 10) Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Оксид серы (IV). Сернистая кислота
Оксид серы (IV). Сернистая кислота Относительные атомные и молекулярные массы
Относительные атомные и молекулярные массы Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Строение атома. Электронные оболочки атома
Строение атома. Электронные оболочки атома Тяжелые металлы. Опасность токсичных металлов для организма
Тяжелые металлы. Опасность токсичных металлов для организма Полибутадиен
Полибутадиен Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Электрохимические методы. Кондуктометрия в анализе объектов окружающей среды
Электрохимические методы. Кондуктометрия в анализе объектов окружающей среды Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода
Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений Озон
Озон Соединения галогенов
Соединения галогенов