Содержание
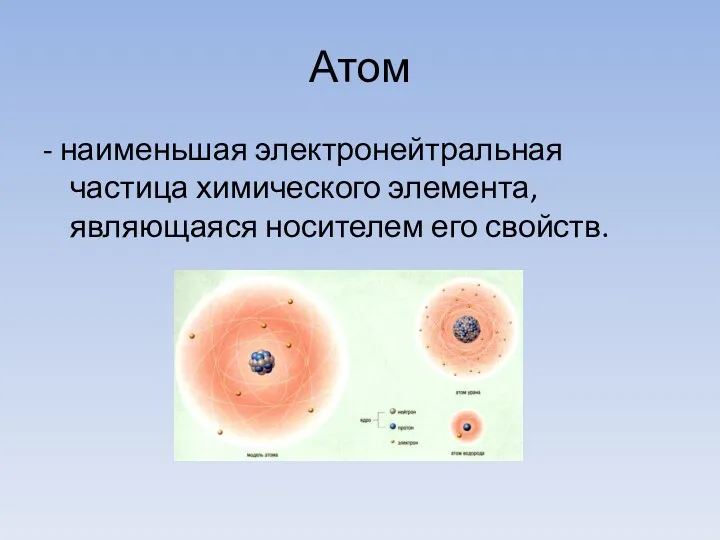
- 2. Атом - наименьшая электронейтральная частица химического элемента, являющаяся носителем его свойств.
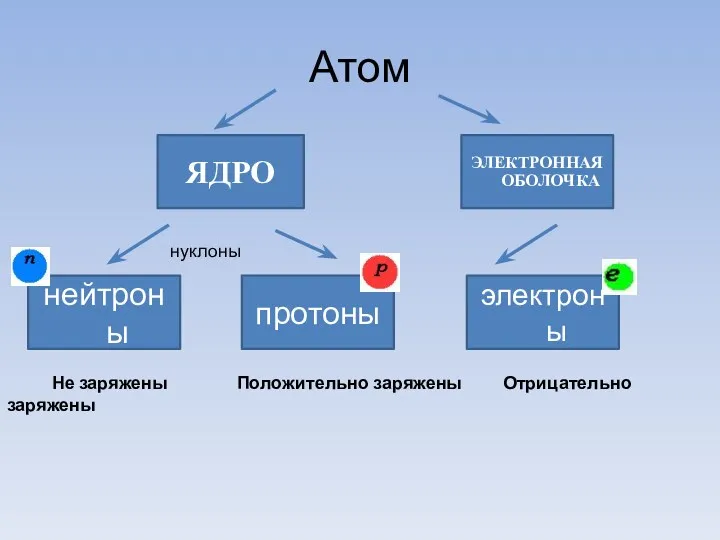
- 3. Атом ЯДРО ЭЛЕКТРОННАЯ ОБОЛОЧКА электроны протоны нейтроны Не заряжены Положительно заряжены Отрицательно заряжены нуклоны
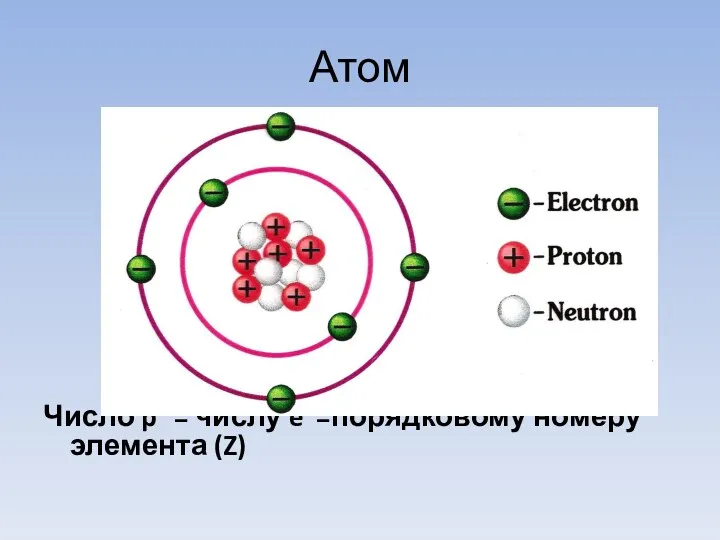
- 4. Атом Число p+ = числу e- =порядковому номеру элемента (Z)
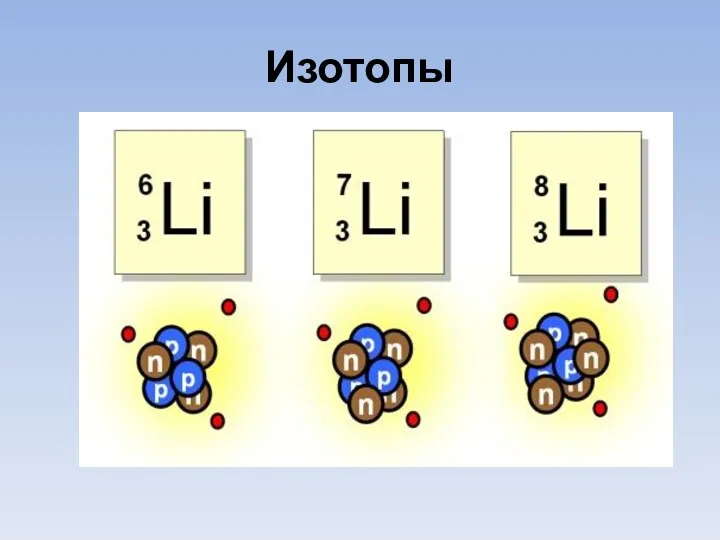
- 5. Изотопы
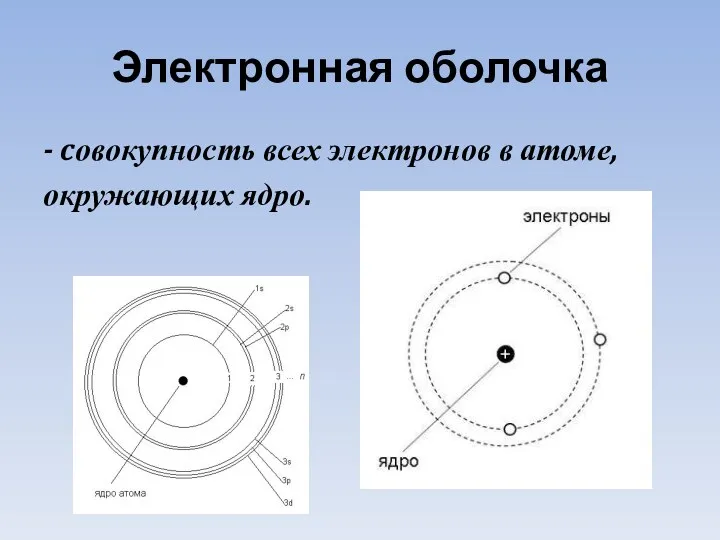
- 6. Электронная оболочка - cовокупность всех электронов в атоме, окружающих ядро.
- 7. Электронные уровни Орбиталь– это область наиболее вероятного местонахождения электрона в пространстве. Номер периода = числу эл.
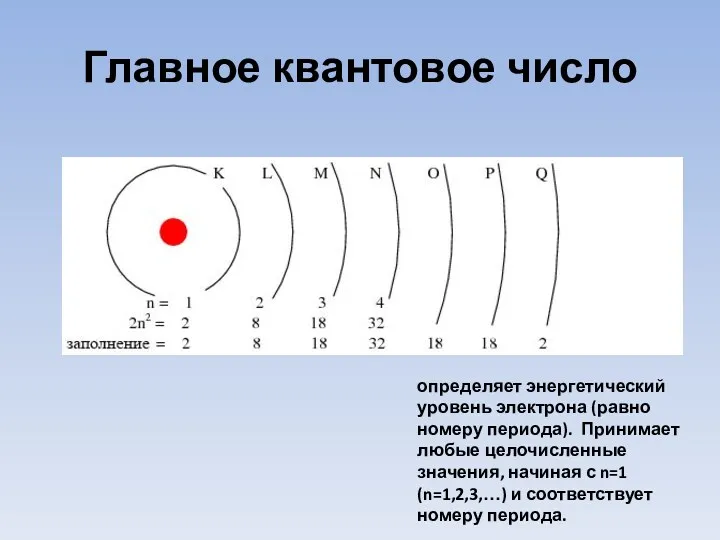
- 8. Главное квантовое число определяет энергетический уровень электрона (равно номеру периода). Принимает любые целочисленные значения, начиная с
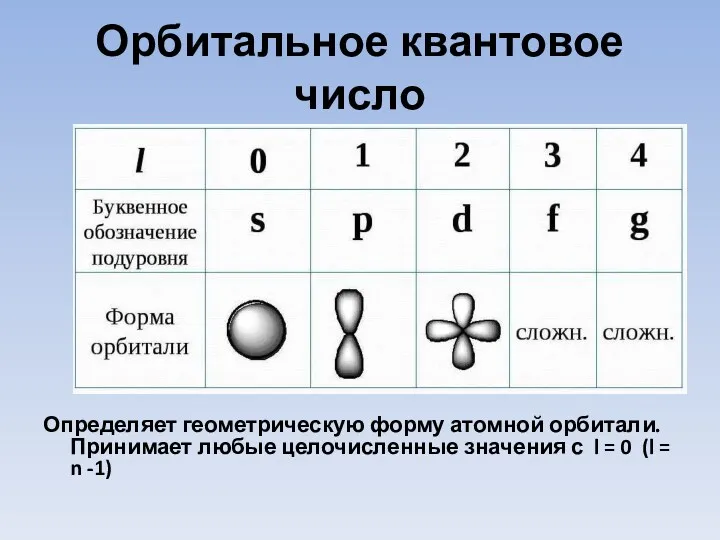
- 9. Орбитальное квантовое число Определяет геометрическую форму атомной орбитали. Принимает любые целочисленные значения с l = 0
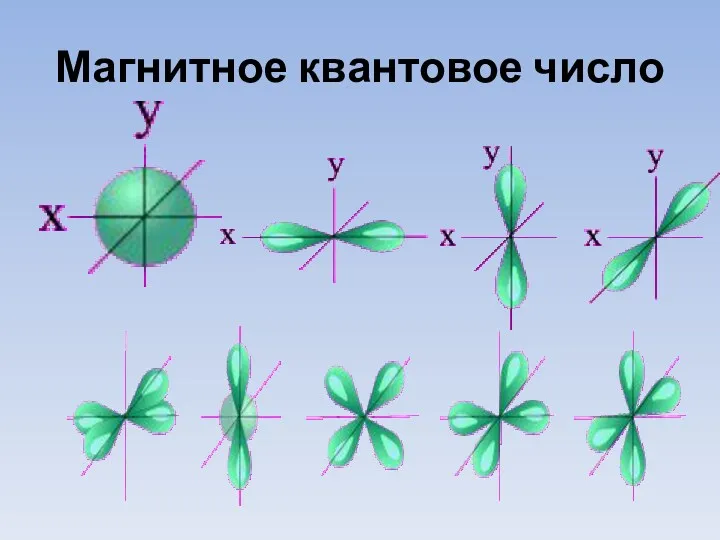
- 10. Магнитное квантовое число
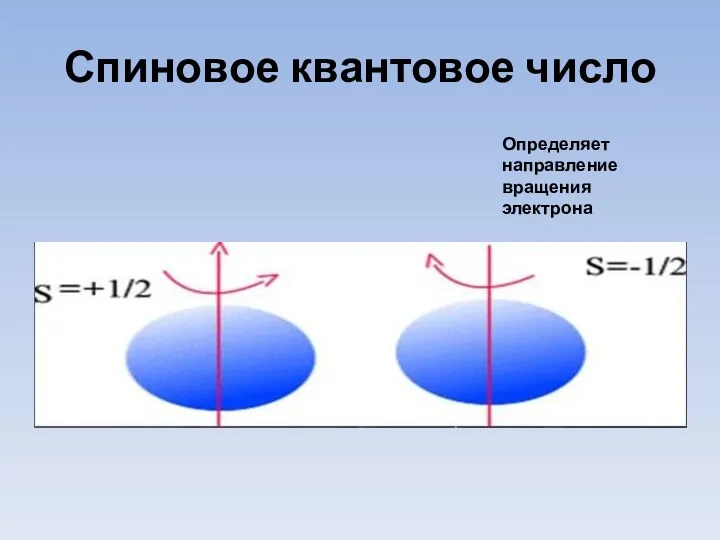
- 11. Спиновое квантовое число Определяет направление вращения электрона
- 12. Основные квантово-механические законы Принцип Паули. Принцип наименьшей энергии. Правило Гунда (Хунда).
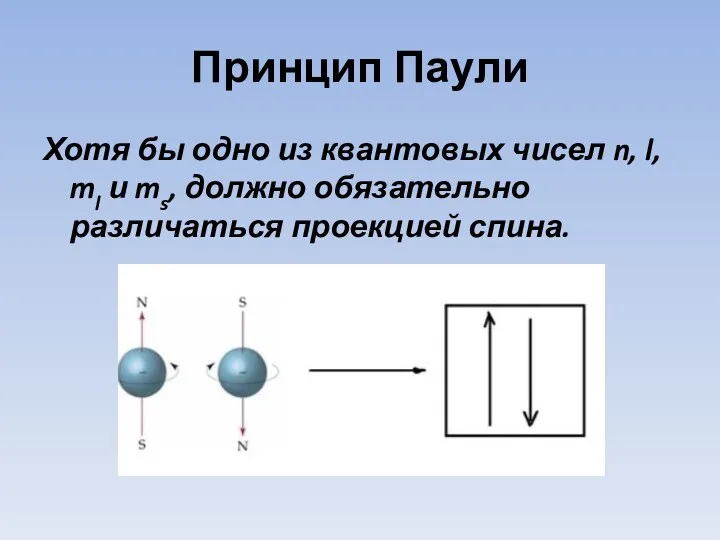
- 13. Принцип Паули Хотя бы одно из квантовых чисел n, l, ml и ms, должно обязательно различаться
- 14. Принцип наименьшей энергии Электроны в основном состоянии заполняют орбитали в порядке повышения уровня их энергии. Первыми
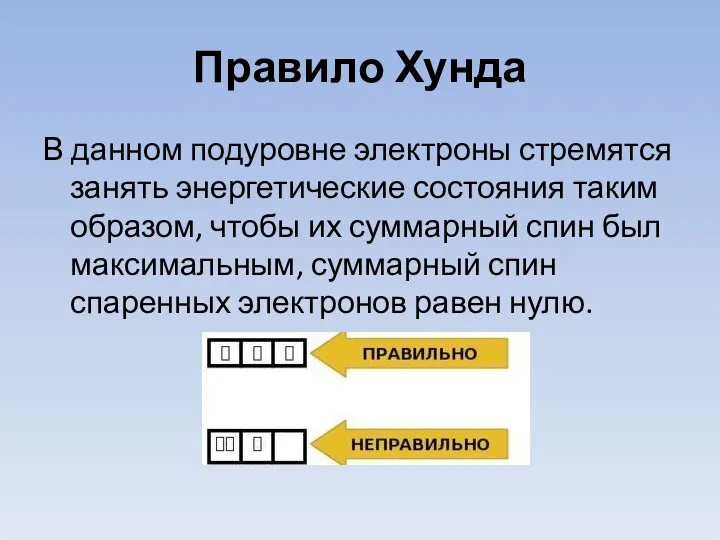
- 15. Правило Хунда В данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы их суммарный спин
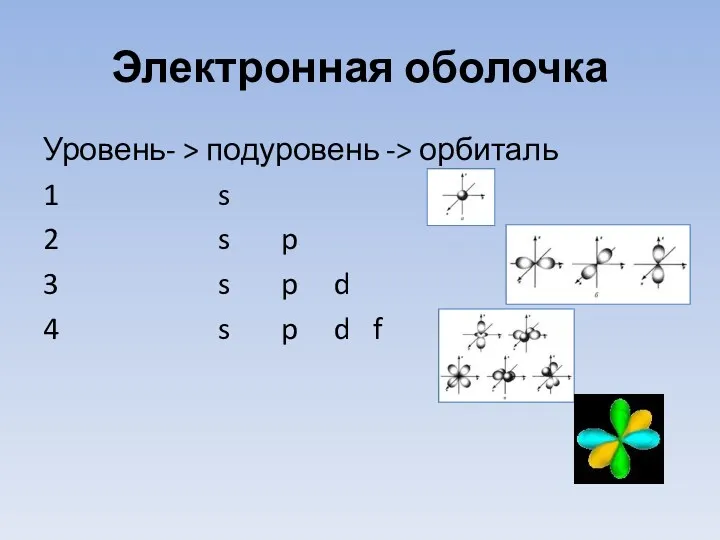
- 16. Электронная оболочка Уровень- > подуровень -> орбиталь 1 s 2 s p 3 s p d
- 17. Электронная оболочка 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 1 уровень = max.
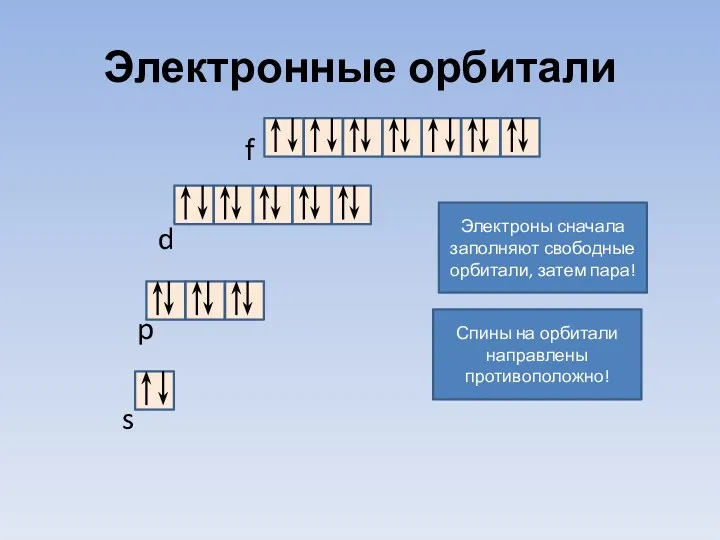
- 18. Электронные орбитали f d p s Электроны сначала заполняют свободные орбитали, затем пара! Спины на орбитали
- 19. Электронная формула Число e- = числу p+ =порядковому номеру Число электронов на внешнем уровне = номеру
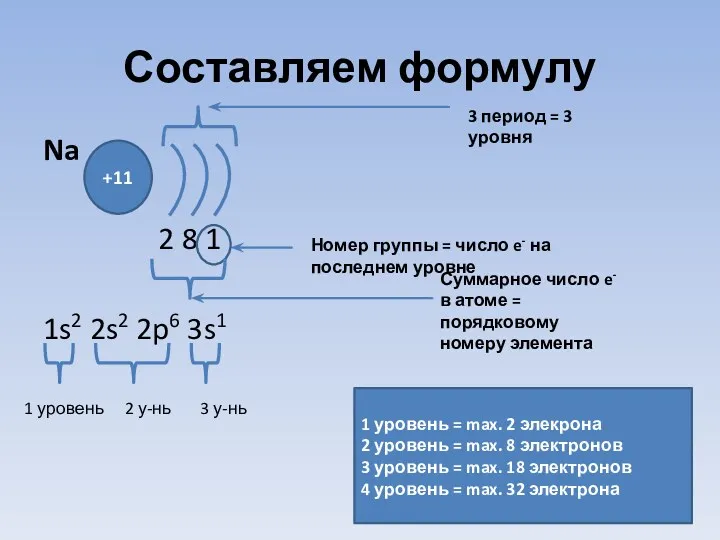
- 20. Составляем формулу Na 2 8 1 1s2 2s2 2p6 3s1 +11 3 период = 3 уровня
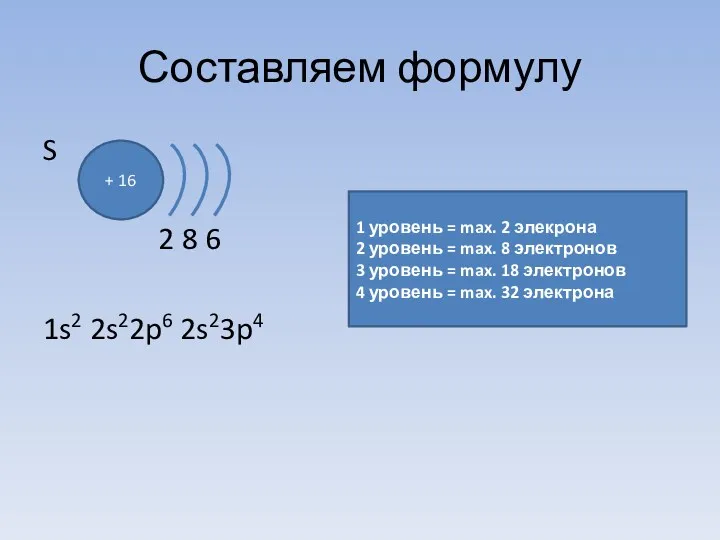
- 21. Составляем формулу S 2 8 6 1s2 2s22p6 2s23p4 + 16 1 уровень = max. 2
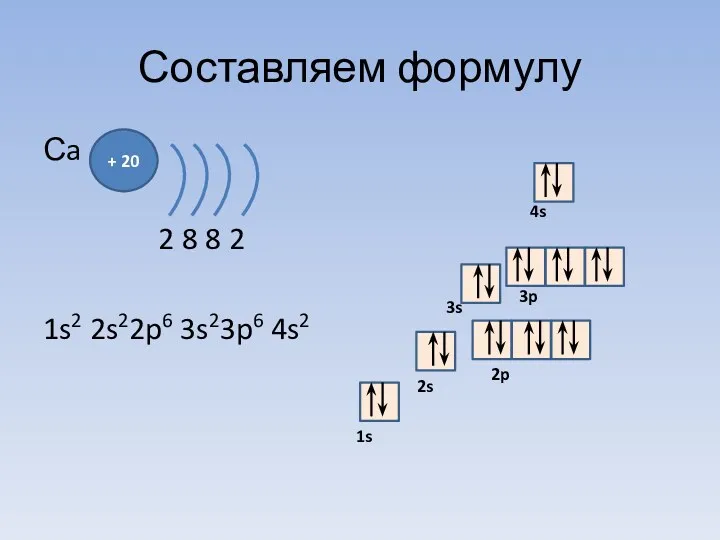
- 22. Составляем формулу Сa 2 8 8 2 1s2 2s22p6 3s23p6 4s2 + 20 1s 2s 2p
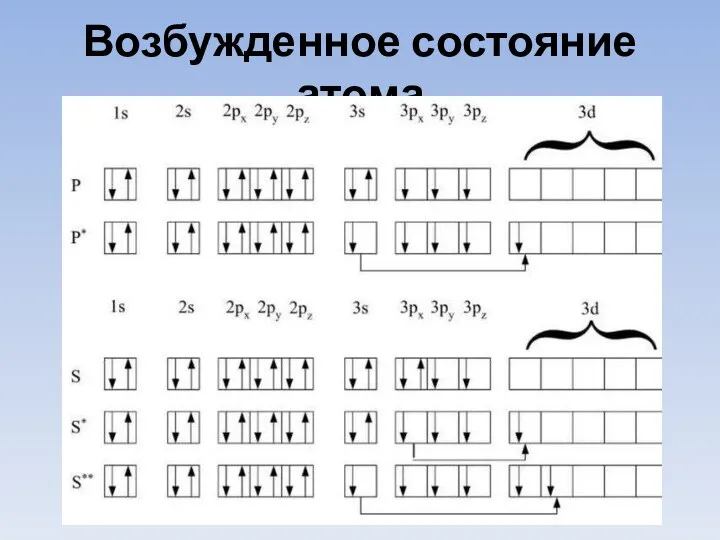
- 23. Возбужденное состояние атома
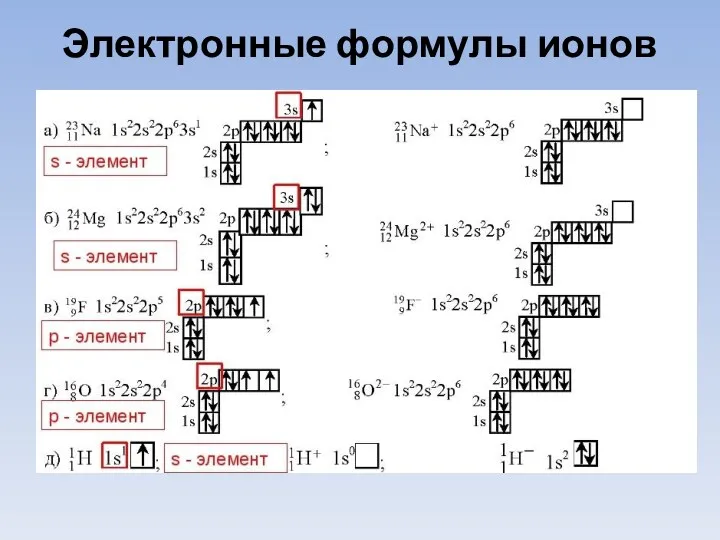
- 24. Электронные формулы ионов
- 25. Решите: Электронную конфигурацию 1s22s22p6 имеют частицы: 1. Na 2. O 3. F– 4. Na+ 5. S2-
- 26. Решите: Хлорид-ион имеет такую же электронную конфигурацию, как и: 1. катион кальция 2. гидрид-анион 3. атом
- 27. Решите: Восьмиэлектронную внешнюю оболочку в основном состоянии имеют частицы: 1. Al3+ 2. C2+ 3. S2- 4.
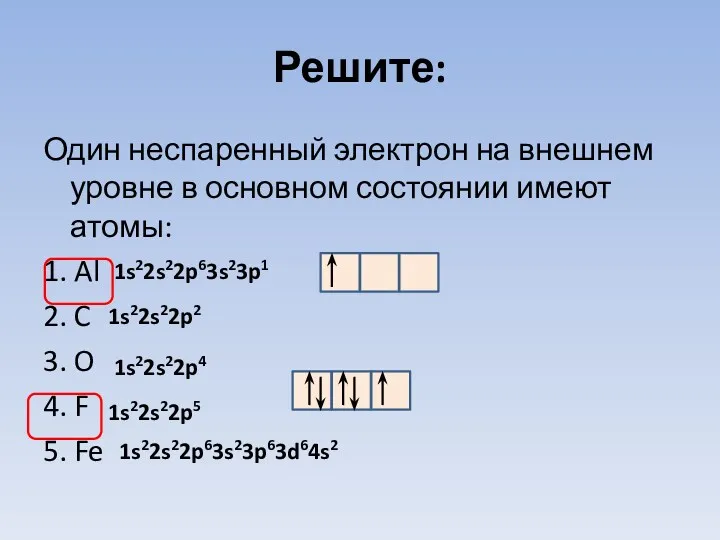
- 28. Решите: Один неспаренный электрон на внешнем уровне в основном состоянии имеют атомы: 1. Al 2. C
- 30. Скачать презентацию








 Крахма́л (C6H10O5)n
Крахма́л (C6H10O5)n Закон сохранения массы. Химические уравнения
Закон сохранения массы. Химические уравнения Химические волокна
Химические волокна Классификация химических реакций
Классификация химических реакций Щелочные металлы
Щелочные металлы Промышленное производство аммиака
Промышленное производство аммиака Л3. Учение о растворах (Химия)
Л3. Учение о растворах (Химия) Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Что такое химия. Техника безопасности. Интересные факты (урок 1)
Что такое химия. Техника безопасности. Интересные факты (урок 1) Создание косметических средств
Создание косметических средств Химия аминокислот, пептидов и белков
Химия аминокислот, пептидов и белков Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы АЛКАНЫ 9 класс
АЛКАНЫ 9 класс Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Калийные Удобрения
Калийные Удобрения Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г
Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г Сплави алюмінію. Характеристики та застосування
Сплави алюмінію. Характеристики та застосування Structural, substructural properties and chemical composition
Structural, substructural properties and chemical composition Количество вещества. Моль
Количество вещества. Моль Общая характеристика углеводов: глюкоза
Общая характеристика углеводов: глюкоза Комплексные соединения и лигандообменные равновесия
Комплексные соединения и лигандообменные равновесия Галогены. Общая характеристика галогенов
Галогены. Общая характеристика галогенов Аммиак
Аммиак Технология переработки полимеров
Технология переработки полимеров Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ)
Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ) Алюминий и его соединения
Алюминий и его соединения Периодический закон Д.И. Менделеева. Периодическая система химических элементов
Периодический закон Д.И. Менделеева. Периодическая система химических элементов Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены