Слайд 2

Кислоты — это сложные вещества, состоящие из атомов водорода и кислотного
остатка.
Задание на повторение. Сделайте его устно.
Формулы каких веществ «лишние» и почему?
1)HCI 2)CO2 3)NaOH 4) H2SO4
5) NaCI 6) H3PO4 7) HNO3 8) H2S
9) СаО 10) H2CO3 11)Н2О 12)Н2SiO4
Слайд 3
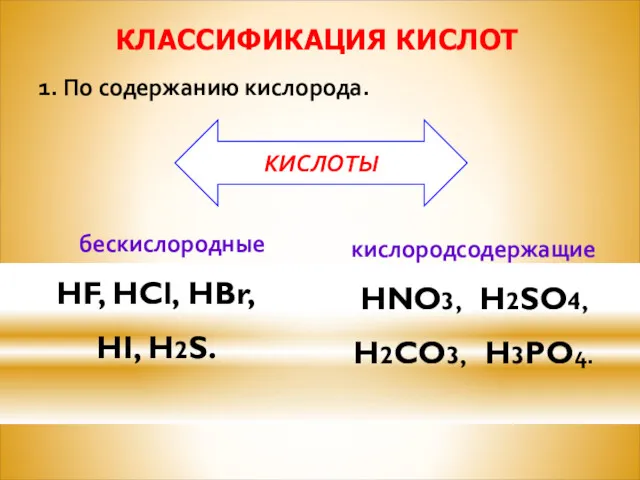
КЛАССИФИКАЦИЯ КИСЛОТ
бескислородные
HF, HCl, HBr,
HI, H2S.
1. По содержанию кислорода.
кислородсодержащие
HNO3, H2SO4,
H2CO3, H3PO4.
КИСЛОТЫ
Слайд 4
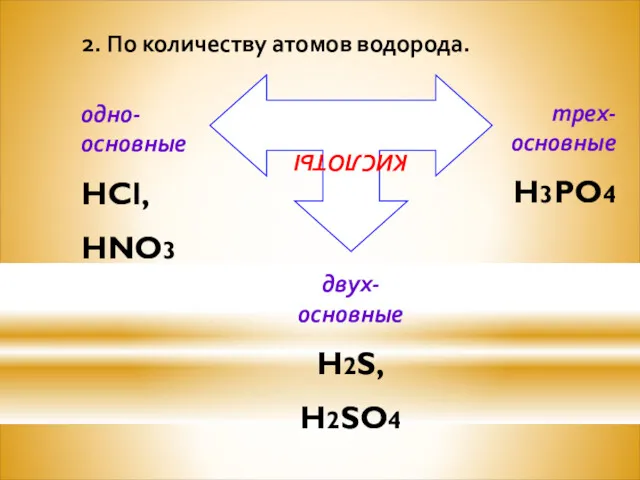
2. По количеству атомов водорода.
КИСЛОТЫ
одно-основные
HCl,
HNO3
двух-основные
H2S,
H2SO4
трех-основные
H3PO4
Слайд 5
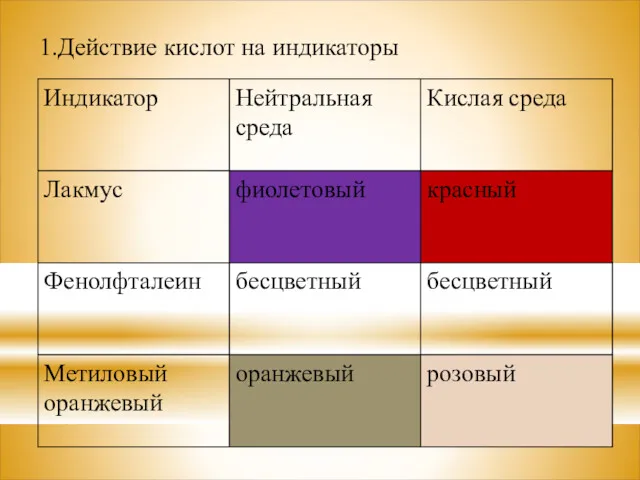
1.Действие кислот на индикаторы
Слайд 6

2.Взаимодействие кислот с металлами
(с кислотами взаимодействуют металлы, стоящие в ряду напряжений
до Н)
Кислота + металл = соль + Н2
Zn+2HCl=ZnCl2+H2↑
Запомните!
При взаимодействии металлов с H2SO4(конц.) и HNO3 (любой концентрации) водород не выделяется.
Слайд 7
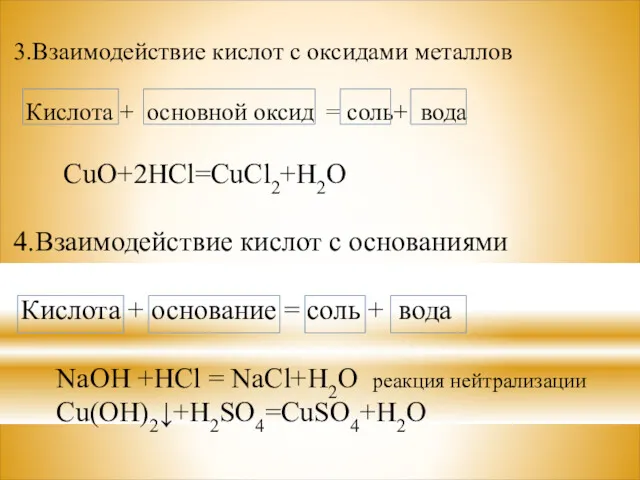
3.Взаимодействие кислот с оксидами металлов
Кислота + основной оксид = соль+
вода
CuO+2HCl=CuCl2+H2O
4.Взаимодействие кислот с основаниями
Кислота + основание = соль + вода
NaOH +HCl = NaCl+H2O реакция нейтрализации
Cu(OH)2↓+H2SO4=CuSO4+H2O
Слайд 8

5.Взаимодействие кислот с солями
(Сильная кислота вытесняет более слабую из раствора соли.
В результате одним из продуктов реакции должны быть либо осадок, либо газ.)
Кислота + соль = новая кислота + новая соль
BaCl2+H2SO4=BaSO4 ↓ +2HCl







 Вещества в твоей жизни
Вещества в твоей жизни Аналитическая химия. Общие понятия
Аналитическая химия. Общие понятия Анионы. Группы анионов
Анионы. Группы анионов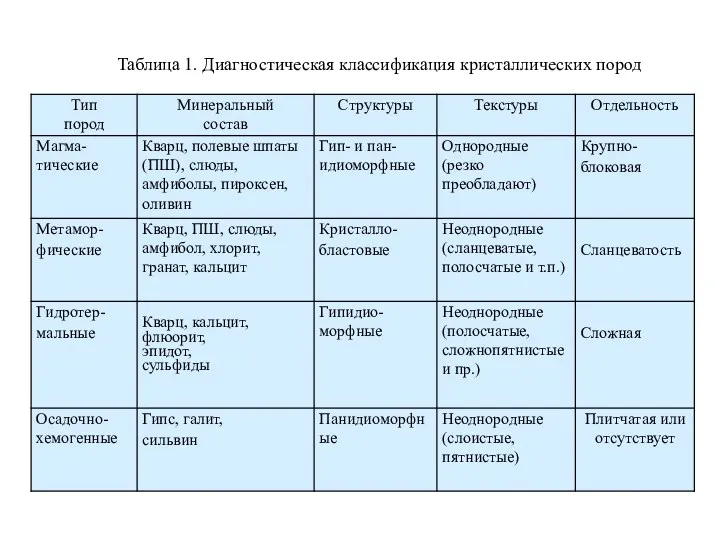 Диагностика метаморфических и гидротермальных горных пород
Диагностика метаморфических и гидротермальных горных пород Химические вещества как строительные и поделочные материалы
Химические вещества как строительные и поделочные материалы Алканы: физические и химические свойства, получение
Алканы: физические и химические свойства, получение Роль хімії в природі
Роль хімії в природі Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева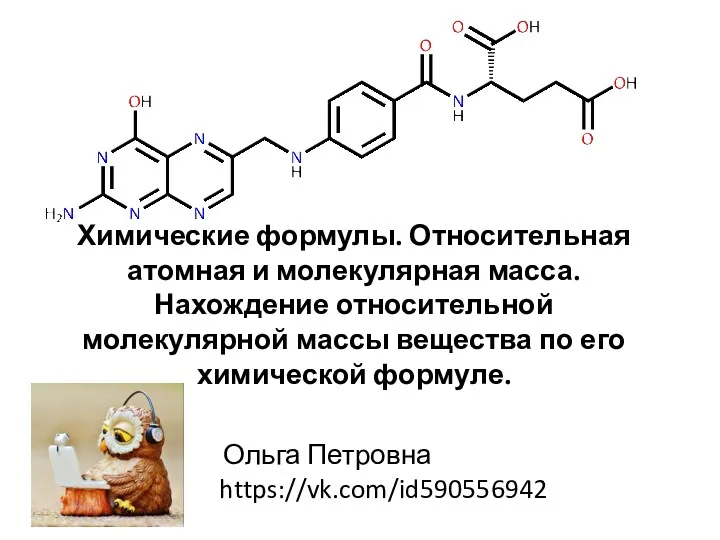 Химические формулы. Относительная атомная и молекулярная масса
Химические формулы. Относительная атомная и молекулярная масса Етери. Ізомерія та номенклатура
Етери. Ізомерія та номенклатура Stoffe bestehen aus kleinsten teilchen
Stoffe bestehen aus kleinsten teilchen Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії
Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії Тема 2. Электронный энергетический спектр как фундаментальная характеристика твердого тела. Перестройка энергетического спектра
Тема 2. Электронный энергетический спектр как фундаментальная характеристика твердого тела. Перестройка энергетического спектра Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Теория электролитической диссоциации
Теория электролитической диссоциации Радиоактивные элементы
Радиоактивные элементы Методы очистки натрия от примесей
Методы очистки натрия от примесей Неметаллы: общая характеристика
Неметаллы: общая характеристика Металлические стёкла
Металлические стёкла Уксусная кислота. Продуценты. Практическое использование
Уксусная кислота. Продуценты. Практическое использование КОВАЛЕНТНАЯ СВЯЗЬ
КОВАЛЕНТНАЯ СВЯЗЬ Введение в неорганическую химию. Классификация неорганических соединений
Введение в неорганическую химию. Классификация неорганических соединений Химические превращения веществ
Химические превращения веществ Соли аммония
Соли аммония Теория электрической диссоциации
Теория электрической диссоциации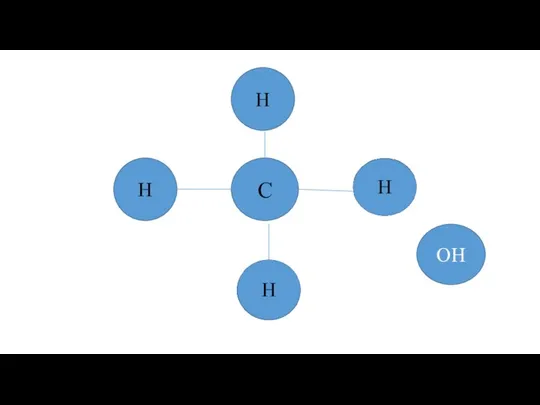 Предельные одноатомные спирты
Предельные одноатомные спирты Геохимия природных процессов. Геохимическая типизация гранитоидов Л.В. Таусона
Геохимия природных процессов. Геохимическая типизация гранитоидов Л.В. Таусона Реакции электрофильного замещения в ароматическом ряду Se
Реакции электрофильного замещения в ароматическом ряду Se