Слайд 2

Пла́тина Элемент 10 группы, 6 периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 78;
благородный металл серо-стального цвета.
Слайд 3

История открытия
Первое упоминание о данном веществе относится к 1557 году, когда
итальянский врач и гуманист Юлий Цезарь Скалигер описал металл, найденный им в Центральной Америке. Расплавить этот металл существовавшими в те времена средствами и способами, которые были доступны испанским конкистадорам, не удалось. Поэтому Скалигер назвал новое химическое вещество платиной, что можно перевести как «маленькое серебро» или даже «серебришко».
Слайд 4

Академик Илья Ильич Черняев(1893-1966). Под его руководством были выполнены многочисленные исследования
соединений платины и других благородных металлов. Историческая справка Профессор Лее Александрович Чугаев (1873-1922) - первый директор Платинового института.
Слайд 5

Содержание в природе
Содержание в природе Платина (Pt) - один из немногих металлов,
найденных в природе в самородном состоянии. Самые большие самородки платины найдены в России. В "шлихах", полученных из россыпей, платина представлена сплавами с железом, мышьяком и металлами платиновой группы в форме зерен размером от 0,1 до 5 мм. Содержание платины в зернах от 65 до 90%. В сульфидных рудах платина присутствует, как в форме собственных мельчайших минералов, так и в форме растворов в минералах цветных металлов, главным образом, никеля. В рудном сырье содержится несколько граммов платины на тонну добываемой руды.
Слайд 6

Физические свойства
Физические свойства Серовато-белый пластичный металл, температуры плавления и кипения –
1769 °C и 3800°C. Платина – один из самых тяжелых (плотность 21,5 г/смі; атомная плотность 6.62•1022 ат/смі) и самых редких металлов: среднее содержание в земной коре 5•10-7% по массе.
Слайд 7

Химические свойства
Химические свойства По химическим свойствам платина похожа на палладий, но
проявляет большую химическую устойчивость. Реагирует только с горячей царской водкой: 3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O Платина медленно растворяется в горячей серной кислоте и жидком броме. Она не взаимодействует с другими минеральными и органическими кислотами. При нагревании реагирует со щелочами и пероксидом натрия, галогенами, а так же с кислородом с образованием летучих оксидов. Как и палладий, платина может растворять молекулярный водород, но объем поглощаемого водорода меньше и способность его отдавать при нагревании у платины меньше.
Слайд 8

Применение
Применение Платина и её сплавы широко используются для производства ювелирных изделий.
Ежегодно мировая ювелирная промышленность потребляет около 50 тонн платины. Российский спрос на ювелирную платину составляет 0,1% от мирового уровня. Платина, золото и серебро – основные металлы, выполняющие монетарную функцию. Однако платину стали использовать для изготовления монет на несколько тысячелетий позже золота и серебра.
Лечебные свойства Платина в отличие от некоторых других металлов не содержит аллергенных примесей. Платина широко используется в медицине. Она не подвергается окислению при контакте с кровью, имеет прекрасные электропроводящие свойства и совместима с человеческими тканями. Благодаря этим свойствам платина используется для электронных стимуляторов сердца. В медицине соединения платины применяются, как цитостатики, однако в настоящее время имеются более эффективные противораковые лекарственные средства.







 Магматические породы и постмагматические процессы
Магматические породы и постмагматические процессы Ion exchange
Ion exchange Электроизоляционные жидкости на основе синтетических углеводородов и других соединений
Электроизоляционные жидкости на основе синтетических углеводородов и других соединений Фосфор
Фосфор Химия. Химиялық термодинамика
Химия. Химиялық термодинамика Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Алкадиены, нафтены
Алкадиены, нафтены Физико-химия дисперсных систем. Физико-химия поверхностных явлений
Физико-химия дисперсных систем. Физико-химия поверхностных явлений Минералы и горные породы
Минералы и горные породы Медь и её соединения
Медь и её соединения Источники низших олефинов
Источники низших олефинов Растворимость, ее зависимость от разных факторов. Насыщенные и ненасыщенные растворы. Физико-химическая сущность растворения
Растворимость, ее зависимость от разных факторов. Насыщенные и ненасыщенные растворы. Физико-химическая сущность растворения Растворы электролитов
Растворы электролитов Натуральный каучук
Натуральный каучук Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение Окислительно-восстановительные реакции. Электролиз
Окислительно-восстановительные реакции. Электролиз Спирты. Понятие о спиртах
Спирты. Понятие о спиртах Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Пластмассалар, пластикалық материалдар
Пластмассалар, пластикалық материалдар Химия, как часть естествознания. Предмет химии
Химия, как часть естествознания. Предмет химии Витамины молока и молочных продуктов. Жирорастворимые витамины
Витамины молока и молочных продуктов. Жирорастворимые витамины Протеины: плюсы и минусы
Протеины: плюсы и минусы Игра по химии В рамках периодической таблицы
Игра по химии В рамках периодической таблицы Вещества. Чистые вещества. Смеси
Вещества. Чистые вещества. Смеси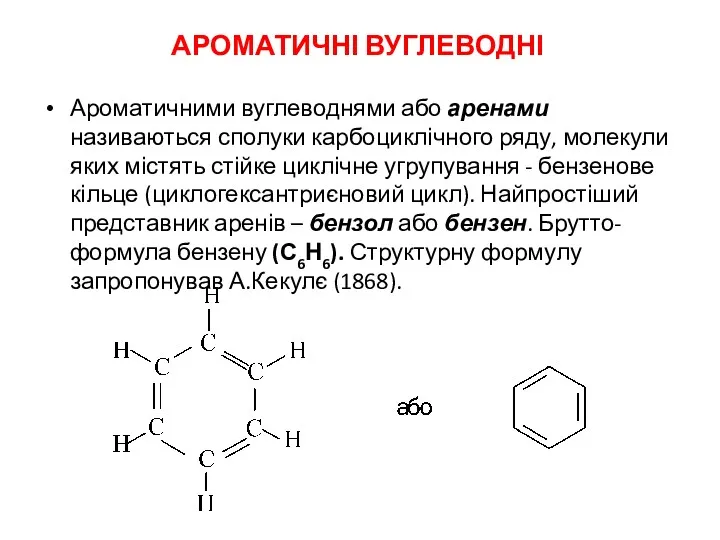 Ароматичні вуглеводні
Ароматичні вуглеводні Химический элемент алюминий
Химический элемент алюминий Минералы. Свойства минералов
Минералы. Свойства минералов Химическое производство (урок по химии в 11 классе)
Химическое производство (урок по химии в 11 классе)