Содержание
- 2. Термодинамика – наука об общих законах, определяющих превращение энергии, без учета микроскопического строения тел, составляющих систему
- 3. Термодинамическая система – выделенная часть объектов окруженных оболочкой. Термодинамика рассматривает три типа систем, различающихся характером взаимодействия
- 4. Состояние термодинамической системы характеризуется физическими величинами, называемыми ТД параметрами системы (объем, давление, температура и др.). Одни
- 5. Энергия – это количественная мера определенного вида движения материи при ее превращении из одного вида в
- 6. Первый закон термодинамики устанавливает, что общая сумма энергии материальной системы остается постоянной величиной независимо от изменений,
- 7. 1.В систему было передано 60 Дж теплоты. Определить изменение внутренней энергии системы, если система при этом
- 8. 2. В систему было передано 60 Дж теплоты и над системой была совершена работа 10 Дж.
- 9. ЗАДАЧИ: 1. В систему было передано 90 Дж теплоты. Определить изменение внутренней энергии системы, если система
- 10. Второй закон термодинамики заключается, в том что все процессы превращения энергии протекают с рассеиванием части энергии
- 11. Существует несколько формулировок второго закона термодинамики: теплота сама собой не может переходить от тела с меньшей
- 12. Внутренняя энергия равна сумме свободной энергии и связанной энергии. Свободная энергия – это та часть внутренней
- 13. Состояние системы при котором свободная энергия равна 0, а энтропия максимальному значению, называется темпо динамическим равновесием.
- 14. Приведенной теплотой (Qпр) называют отношение количества теплоты (Q), отданное системой к абсолютной температуре (T), при которой
- 15. 1. Системе сообщили количество теплоты 50 Дж при температуре 10 градусов Цельсия. Определите приведенную теплоту. Ответ:
- 16. В результате необратимого процесса внутри системы энтропия возрастает на 9,2 кДж/К за время t=20 c. Вычислите
- 17. 3. Вычислите общее изменение энтропии в открытой системе, если известно, что в результате необратимых процессов внутри
- 18. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. Найдите приведенную теплоту, если системой было отдано в виде тепла 210
- 20. Скачать презентацию

















 Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії
Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії Предмет органической химии
Предмет органической химии Кристаллическая структура твердых тел. Межатомные взаимодействия и классификация твердых тел
Кристаллическая структура твердых тел. Межатомные взаимодействия и классификация твердых тел Сұйықтардағы газ ерітінділері. Генри заңы. Сұйық-сұйық ерітінділердегі бу қысымы. Рауль заңынын ауытқу. Криометрия
Сұйықтардағы газ ерітінділері. Генри заңы. Сұйық-сұйық ерітінділердегі бу қысымы. Рауль заңынын ауытқу. Криометрия Углепластики
Углепластики Химическая технология органических веществ
Химическая технология органических веществ Аналитические химические реакции. Классификация аналитических химических реакций
Аналитические химические реакции. Классификация аналитических химических реакций Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей Молекулы и атомы. Броуновское движение
Молекулы и атомы. Броуновское движение Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Хімія запаху і смаку
Хімія запаху і смаку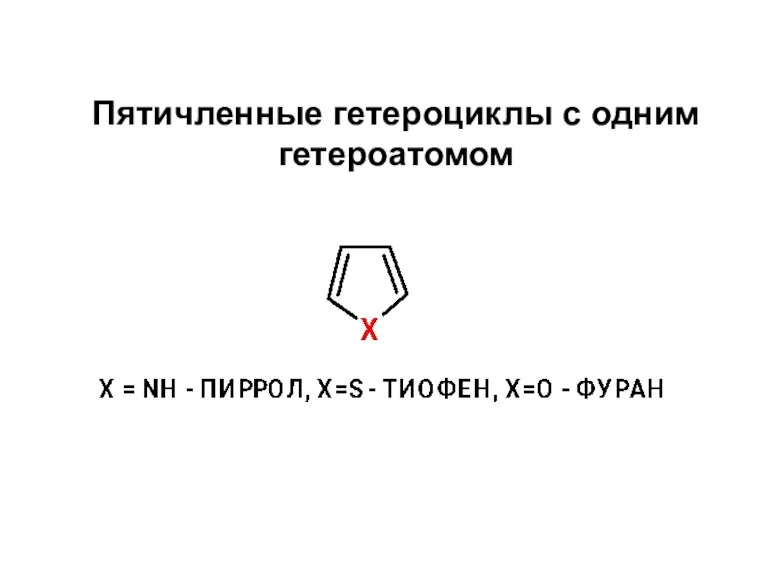 Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом Термодинамика химических процессов
Термодинамика химических процессов Процессы нитрования
Процессы нитрования Химия в косметологии
Химия в косметологии Edexcel organic reaction mechanisms
Edexcel organic reaction mechanisms Классификация химических реакций, протекающих с изменением состава веществ
Классификация химических реакций, протекающих с изменением состава веществ Химическая связь. Кристаллические решетки. (Лекция 2.2)
Химическая связь. Кристаллические решетки. (Лекция 2.2) Азот: кислородные соединения. Особенности химии фосфора и элементов его подгруппы
Азот: кислородные соединения. Особенности химии фосфора и элементов его подгруппы Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Классификация топлива. Показатели качества топлива (Лекция 1)
Классификация топлива. Показатели качества топлива (Лекция 1) Важнейшие минералы
Важнейшие минералы Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Химия и пища. Маркировка, упаковка пищевых и гигиенических продуктов
Химия и пища. Маркировка, упаковка пищевых и гигиенических продуктов СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ
СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ Методы очистки нефтяных фракций
Методы очистки нефтяных фракций Минеральные удобрения
Минеральные удобрения Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение