Содержание
- 2. Химическая связь – это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Различают
- 3. это связь, возникающая между атомами за счет образования общих электронных пар. По степени смещенности общих электронных
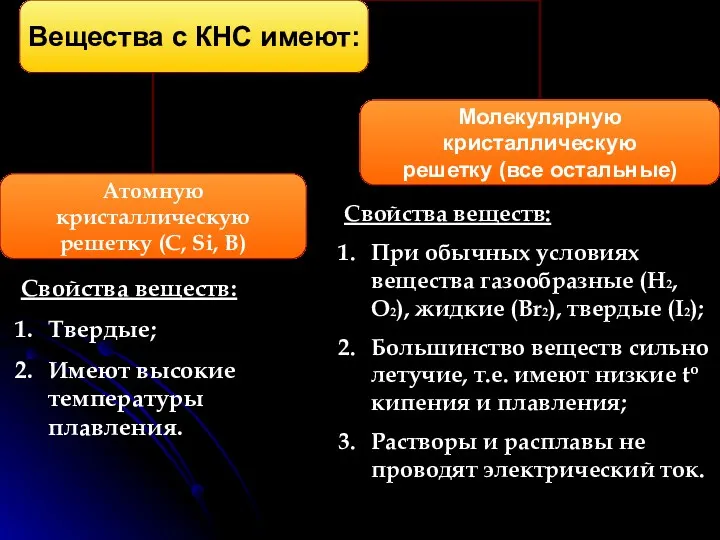
- 4. КНС образуют атомы одного и того же химического элемента. Механизм образования связи. Каждый атом неметалла отдает
- 5. Свойства веществ: Твердые; Имеют высокие температуры плавления. Свойства веществ: При обычных условиях вещества газообразные (H2, O2),
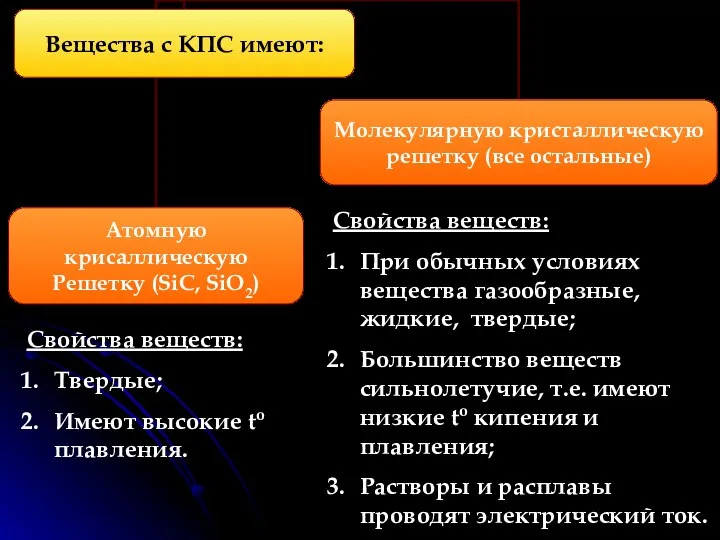
- 6. КПС образуют атомы разных неметаллов (с разной электороотрицательностью). Электроотрицательность (ЭО)- это свойство атомов одного элемента притягивать
- 7. Свойства веществ: При обычных условиях вещества газообразные, жидкие, твердые; Большинство веществ сильнолетучие, т.е. имеют низкие to
- 8. ИС образуется между атомами металлов и неметаллов, т.е. между атомами резко отличающимися друг от друга по
- 9. Свойства веществ: Все вещества при обычных условиях твердые. Имеют высокие температуры кипения и плавления. Расплавы и
- 10. Металлическая связь – связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов
- 11. Водородная связь – связь между атомами водорода одной молекулы и сильноотрицательными элементами (O, N, F) другой
- 13. Скачать презентацию








 Натуральный и синтетический каучуки. Резина
Натуральный и синтетический каучуки. Резина Кислотно-основные (протолитические) равновесия
Кислотно-основные (протолитические) равновесия Основания (3)
Основания (3) Нафталин
Нафталин Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Химическая связь
Химическая связь AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі
AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі Подземное хранение газа и жидкости
Подземное хранение газа и жидкости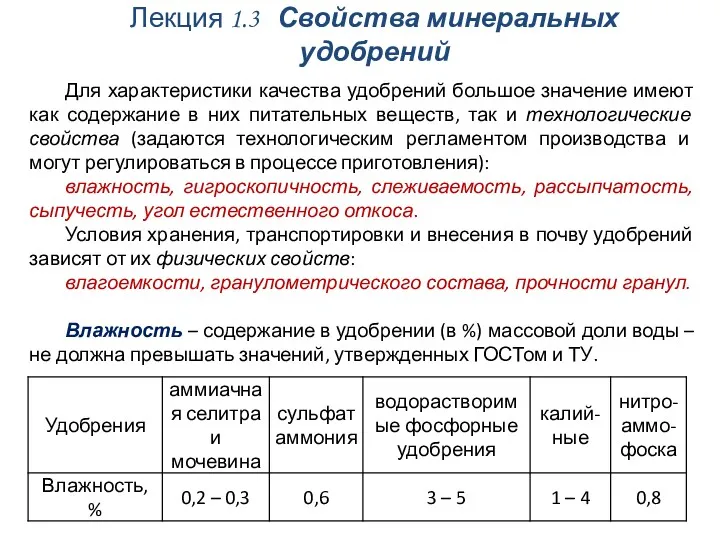 Свойства минеральных удобрений
Свойства минеральных удобрений Химическая кинетика
Химическая кинетика Классификация и свойства кислот
Классификация и свойства кислот Виведення формул органічних сполук за масовими частками елементів
Виведення формул органічних сполук за масовими частками елементів Полудрагоценные камни
Полудрагоценные камни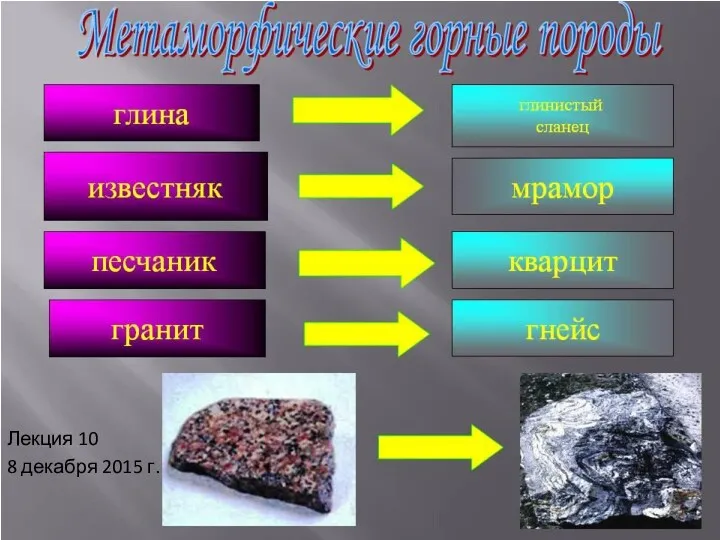 Метаморфические породы. (Лекция 10)
Метаморфические породы. (Лекция 10) Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Оксид серы (IV). Сернистая кислота
Оксид серы (IV). Сернистая кислота Относительные атомные и молекулярные массы
Относительные атомные и молекулярные массы Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Строение атома. Электронные оболочки атома
Строение атома. Электронные оболочки атома Тяжелые металлы. Опасность токсичных металлов для организма
Тяжелые металлы. Опасность токсичных металлов для организма Полибутадиен
Полибутадиен Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Электрохимические методы. Кондуктометрия в анализе объектов окружающей среды
Электрохимические методы. Кондуктометрия в анализе объектов окружающей среды Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода
Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений Озон
Озон Соединения галогенов
Соединения галогенов