Содержание
- 2. 1/ GIỚI THIỆU 2/ ĐÁNH GIÁ CÔNG NGHỆ Y TẾ 3/QUẢN LÍ CÔNG NGHỆ Y TẾ
- 3. GIỚI THIỆU Công nghệ y tế là gì?
- 4. 1. ĐÁNH GIÁ CÔNG NGHỆ Y TẾ 1.1 TIÊU CHUẨN ĐÁNH GIÁ CÔNG NGHỆ Y TẾ
- 5. HTAi: Health Technology Assessment international FDA: Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ
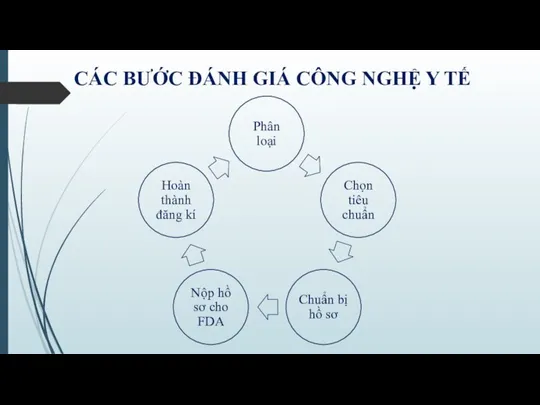
- 6. CÁC BƯỚC ĐÁNH GIÁ CÔNG NGHỆ Y TẾ
- 7. Phân loại: - Loại I - Rủi ro thấp - Loại II - Rủi ro vừa
- 8. 1.2. KHÓ KHĂN Ở CÁC NƯỚC PHÁT TRIỂN Chi phí thành lập và duy trì, cơ
- 9. ĐÁNH GIÁ CÔNG NGHỆ Y TẾ Ở VIỆT NAM Tình hình: Nhập khẩu 90% TBYT, Việt
- 10. NỘI DUNG ĐÀO TẠO CÁN BỘ QUẢN LÍ TTBYT Ở VIỆT NAM Cập nhật kiến thức
- 11. 2. QUẢN LÍ CÔNG NGHỆ Y TẾ 2.1 Khái niệm 2.2 Quy định đổi mới thiết
- 12. QUẢN LÍ CÔNG NGHỆ Do công nghệ y tế tiếp tục phát triển, nó tác động
- 13. 2.1 KẾ HOẠCH CHIẾN LƯỢC CÔNG NGHỆ Lâm sàng và kế hoạch công nghệ chiến lược
- 14. QÚA TRÌNH LẬP KẾ HOẠCH CHIẾN LƯỢC CÔNG NGHỆ Tiến hành một cách hiệu quả việc
- 15. Giám đốc lập kế hoạch(giám đốc kỹ thuật lâm sàng) để có những trách nhiệm đánh
- 16. 2.2 ĐÁNH GIÁ CÔNG NGHỆ [3] Để thành công, một quá trình đánh giá công nghệ
- 17. QUY TRÌNH ĐÁNH GIÁ CÔNG NGHỆ[5] (1) Tích lũy thông tin về thiết bị y tế
- 18. Các MTAC có thẩm quyền để đề nghị hoặc chấp nhận hoặc từ chối bất kỳ
- 19. 2.3 LẬP KẾ HOẠCH THIẾT BỊ, MUA SẮM: 2.3.1 Quy định đổi mới thiết bị y
- 20. 2.3.1 QUY ĐỊNH ĐỔI MỚI VỀ THIẾT BỊ Y TẾ [2] 1938: thiết bị y tế
- 21. 2.3.2 Bốn quy tắc tiếp thị thiết bị y tế ở thị trường Mỹ[2]: 1 2
- 22. 2.3.3 Nghiên cứu khả thi[2] [2] John D. Enderle, Joseph D. Bronzino , Introduction to Biomedical
- 23. 2.3.4 Y đức trong trường hợp cấp cứu[2] FDA đã cho phép sử dụng các thiết
- 24. 2.3.5 Vấn đề đạo đức trong điều trị[2] FDA cho phép sử dụng các thuốc chưa
- 25. 2.4 TRIỂN KHAI VÀ THU HỒI THIẾT BỊ [3] [3] Yadin David et al.: clinical engineering
- 26. [3] Yadin David et al.: clinical engineering , CRC Press, 2006 QUI TRÌNH TIẾP NHẬN CÔNG
- 27. Quá trình mua bán: được diễn ra bao gồm các loại giấy tờ cần thiết minh
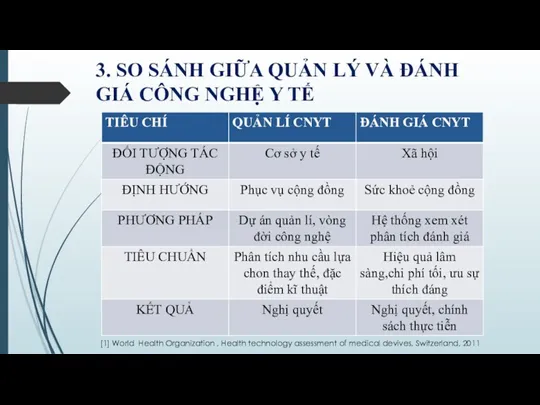
- 28. 3. SO SÁNH GIỮA QUẢN LÝ VÀ ĐÁNH GIÁ CÔNG NGHỆ Y TẾ [1] World Health
- 29. 4. TÀI LIỆU THAM KHẢO [1] World Health Organization , Health technology assessment of medical devives,
- 31. Скачать презентацию












![2.2 ĐÁNH GIÁ CÔNG NGHỆ [3] Để thành công, một](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/197903/slide-15.jpg)
![QUY TRÌNH ĐÁNH GIÁ CÔNG NGHỆ[5] (1) Tích lũy thông](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/197903/slide-16.jpg)




![2.3.3 Nghiên cứu khả thi[2] [2] John D. Enderle, Joseph](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/197903/slide-21.jpg)
![2.3.4 Y đức trong trường hợp cấp cứu[2] FDA đã](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/197903/slide-22.jpg)
![2.3.5 Vấn đề đạo đức trong điều trị[2] FDA cho](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/197903/slide-23.jpg)
![2.4 TRIỂN KHAI VÀ THU HỒI THIẾT BỊ [3] [3]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/197903/slide-24.jpg)
![[3] Yadin David et al.: clinical engineering , CRC Press,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/197903/slide-25.jpg)

![4. TÀI LIỆU THAM KHẢO [1] World Health Organization ,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/197903/slide-28.jpg)
 Pharmacovigilance. Marta D. Puente Navazo January 2017
Pharmacovigilance. Marta D. Puente Navazo January 2017 Жарақаттар (буынның шығуы, сынық)
Жарақаттар (буынның шығуы, сынық) Профилактика и лечение нарушения осанки и сколиоза у детей
Профилактика и лечение нарушения осанки и сколиоза у детей Здоровье, предболезнь, болезнь и профилактика
Здоровье, предболезнь, болезнь и профилактика Дифференциальная диагностика внутрикостных остеолитических образований
Дифференциальная диагностика внутрикостных остеолитических образований ЗВУР. Маловесный к сроку гестации. Гравидограмма
ЗВУР. Маловесный к сроку гестации. Гравидограмма Неингаляционная анестезия
Неингаляционная анестезия Көпіршікті дерматоздар (пемфигус)
Көпіршікті дерматоздар (пемфигус) Апитерапия. Гирудотерапия. Медициналық препараттары
Апитерапия. Гирудотерапия. Медициналық препараттары Экзогенные и соматогенные психические расстройства
Экзогенные и соматогенные психические расстройства Рак поджелудочной железы
Рак поджелудочной железы Холера. Клиническая картина. Лечение. Профилактика
Холера. Клиническая картина. Лечение. Профилактика Организация oнкологической службы в России
Организация oнкологической службы в России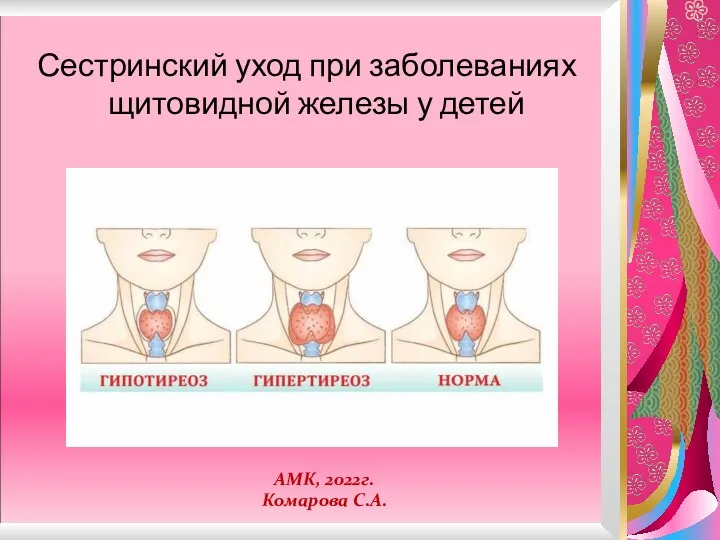 Щитовидная железа Комарова С.А.2022
Щитовидная железа Комарова С.А.2022 Черепно-мозговая травма. Классификация
Черепно-мозговая травма. Классификация Физическое развитие детей и факторы, его определяющие. Законы роста. Часть 1
Физическое развитие детей и факторы, его определяющие. Законы роста. Часть 1 Сестринский уход и введение центрального венозного катетера
Сестринский уход и введение центрального венозного катетера Көру ағзасының қалыптасуы ( эмбриогенез)
Көру ағзасының қалыптасуы ( эмбриогенез) Правовые и организационные основы судебно-медицинской экспертизы
Правовые и организационные основы судебно-медицинской экспертизы БДСҰ ұсынысы бойынша ана сүтімен тамақтануға дайындау,жанұяны жоспарлау,контрацепция,аналық сүт безі обыры
БДСҰ ұсынысы бойынша ана сүтімен тамақтануға дайындау,жанұяны жоспарлау,контрацепция,аналық сүт безі обыры Хроническая сердечная недостаточность
Хроническая сердечная недостаточность Задачи и основы организации федеральной медицинской службы гражданской обороны
Задачи и основы организации федеральной медицинской службы гражданской обороны Хроматография түрлері. Жұқа қабатты хроматография
Хроматография түрлері. Жұқа қабатты хроматография Нарушения мозгового кровообращения на догоспитальном этапе
Нарушения мозгового кровообращения на догоспитальном этапе Дегенеративно -диструктивные изменения позвоночника
Дегенеративно -диструктивные изменения позвоночника Гелиотерапия
Гелиотерапия Дизентерия (шигеллез)
Дизентерия (шигеллез) Поняття про пухлину та пухлинний процес
Поняття про пухлину та пухлинний процес