Содержание
- 2. Правила составления ОВР
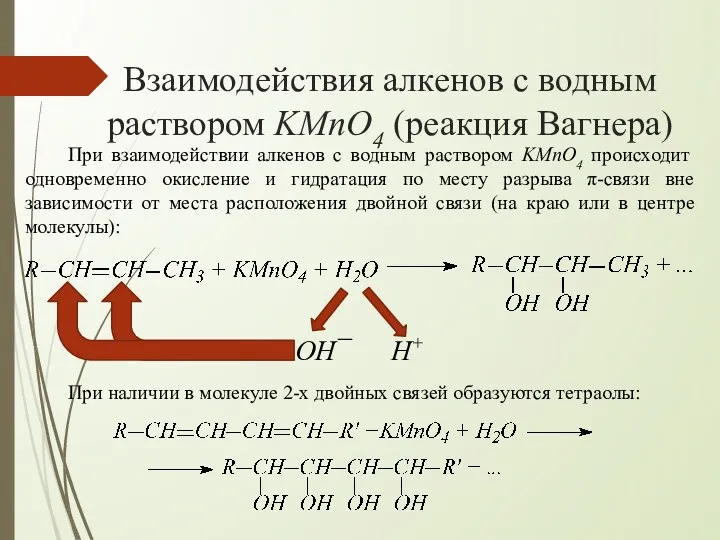
- 3. Взаимодействия алкенов с водным раствором KMnO4 (реакция Вагнера) При взаимодействии алкенов с водным раствором KMnO4 происходит
- 4. Взаимодействия алкенов с раствором KMnO4 в серной кислоте при tºC При действии KMnO4 в H2SO4 при
- 5. Взаимодействия алкенов с раствором KMnO4 в серной кислоте при tºC в) если двойная связь находится при
- 6. Взаимодействия алкадиенов с раствором KMnO4 в серной кислоте при tºC Если в молекуле 2 двойных связи,
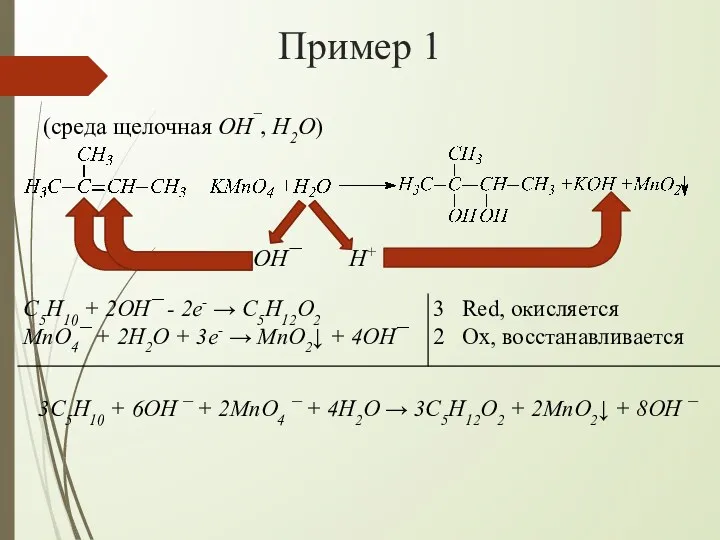
- 7. Пример 1 (среда щелочная OH¯, H2O) OH¯ H+ 3C5H10 + 6OH ¯ + 2MnO4 ¯ +
- 8. Пример 1 Сокращаем одинаковые частицы в левой и правой частях схемы и получаем: 3C5H10 + 2MnO4
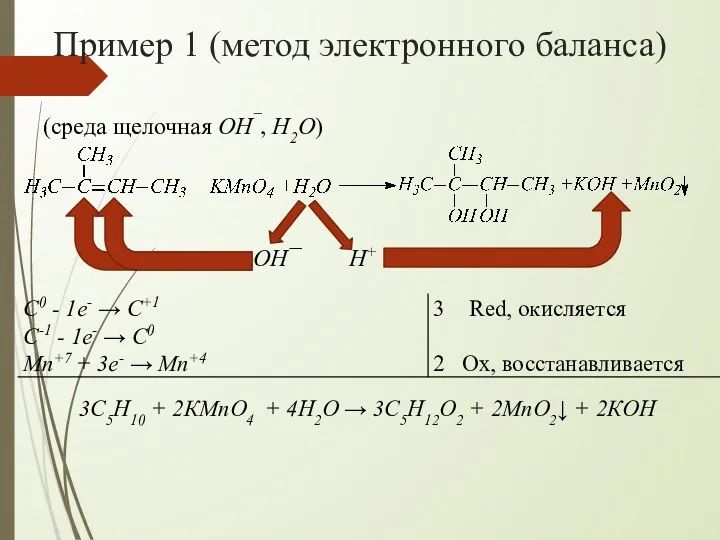
- 9. Пример 1 (метод электронного баланса) (среда щелочная OH¯, H2O) OH¯ H+ 3C5H10 + 2КMnO4 + 4H2O
- 10. Пример 2 (среда кислотная H+, H2O). 5C5H10 + 15H2O + 6MnO4 ¯ + 48H+ → →
- 11. Пример 2 Сокращаем одинаковые частицы в левой и правой частях схемы и получаем: Записываем УХР в
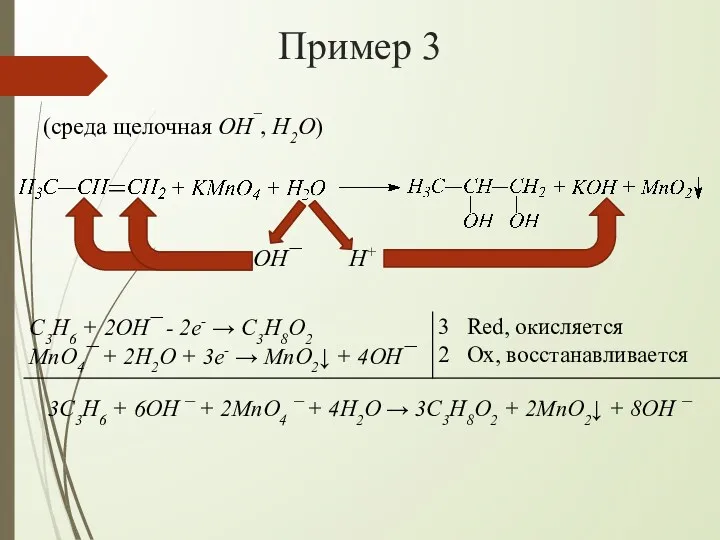
- 12. Пример 3 (среда щелочная OH¯, H2O) OH¯ H+ 3C3H6 + 6OH ¯ + 2MnO4 ¯ +
- 13. Пример 3 Сокращаем одинаковые частицы в левой и правой частях схемы и получаем: Записываем УХР в
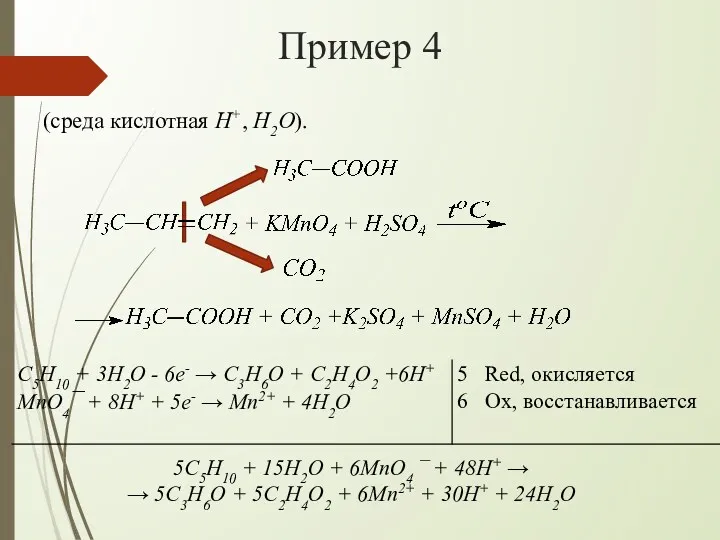
- 14. Пример 4 (среда кислотная H+, H2O). 5C5H10 + 15H2O + 6MnO4 ¯ + 48H+ → →
- 15. Пример 4 Сокращаем одинаковые частицы в левой и правой частях схемы и получаем: Записываем УХР в
- 17. Скачать презентацию









 Новосибирск
Новосибирск Презентация к 8 Марта
Презентация к 8 Марта Схемы глубокой переработки нефти
Схемы глубокой переработки нефти История песни Катюша
История песни Катюша William Shakespeare (1564-1616)
William Shakespeare (1564-1616) Дербес компьютердің құрамы
Дербес компьютердің құрамы Приёмная кампания КГУ 2018
Приёмная кампания КГУ 2018 Психология как профессия
Психология как профессия Автоматизация звука Ж.
Автоматизация звука Ж. Основы научных исследований в растениеводстве и животноводстве
Основы научных исследований в растениеводстве и животноводстве Кинетика. Химическое равновесие
Кинетика. Химическое равновесие Определённый артикль. Неопределённый артикль. Нулевой артикль
Определённый артикль. Неопределённый артикль. Нулевой артикль Исследование и анализ рынка
Исследование и анализ рынка Философия и медицина
Философия и медицина Клиническая симптоматология гастритов и язвенной болезни
Клиническая симптоматология гастритов и язвенной болезни Столетняя война 1337-1453
Столетняя война 1337-1453 Признаки новой экономической эпохи
Признаки новой экономической эпохи Қазфосфат. Мықты жағы
Қазфосфат. Мықты жағы :Здоровые дети в здоровой семье.
:Здоровые дети в здоровой семье. Презентация для игры к 23 февраля - 1 класс
Презентация для игры к 23 февраля - 1 класс Его величество фортепиано
Его величество фортепиано Одеський порт
Одеський порт Искусство аниме
Искусство аниме Методические рекомендации по разработке и оформлению дополнительной общеобразовательной общеразвивающей программы
Методические рекомендации по разработке и оформлению дополнительной общеобразовательной общеразвивающей программы Понятие и правовое значение суверенитета
Понятие и правовое значение суверенитета Стародавня Індія
Стародавня Індія Контраст. Система Иттена
Контраст. Система Иттена toser
toser