Содержание
- 2. Электролитическая диссоциация
- 3. Положительно заряженный электрод Отрицательно заряженный электрод Направленное движение заряженных частиц Положительно заряженные частицы Отрицательно заряженные частицы
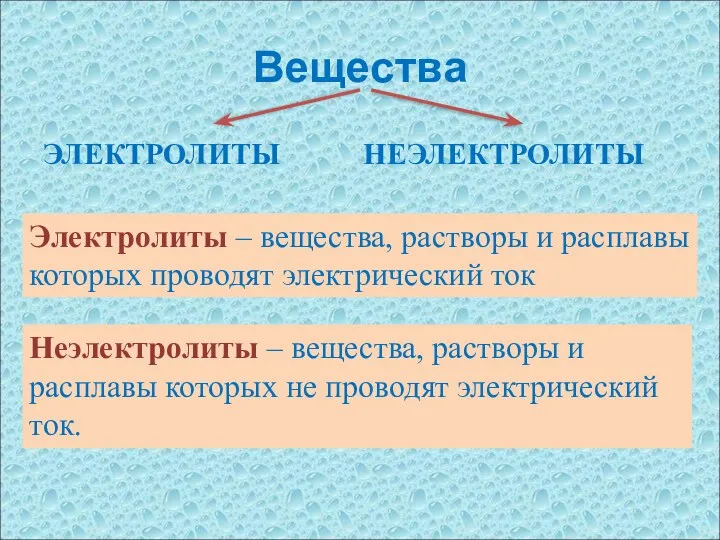
- 4. Вещества ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫ Неэлектролиты – вещества, растворы и расплавы которых не проводят электрический ток. Электролиты –
- 5. Английский физик и химик, один из основателей электрохимии В конце 18 века он приобрел репутацию хорошего
- 6. Первые его работы в области электрохимии были посвящены изучению действия электрического тока на химические соединения. Он
- 7. Почему растворы электролитов проводят электрический ток? Сванте Аррениус (1859-1927) Создал теорию электролитической диссоциации. За исследования в
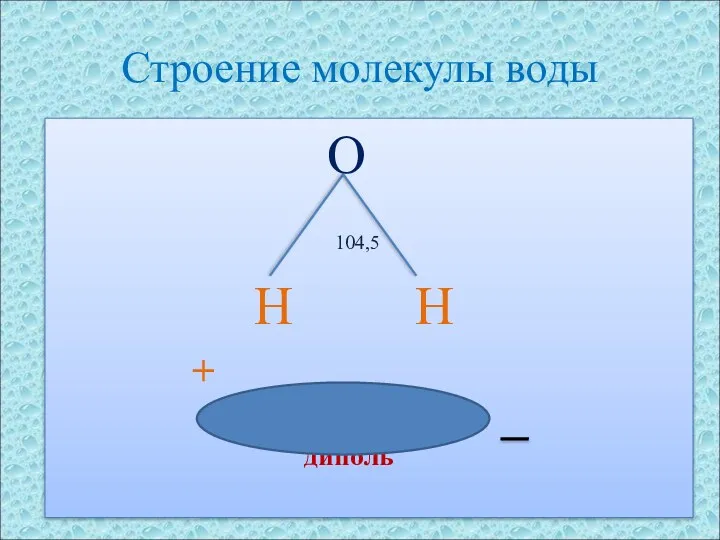
- 8. Строение молекулы воды O 104,5 H H + диполь
- 9. Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении.
- 10. Легче всего диссоциируют вещества с ионной и ковалентной полярной связью: Кислоты : HCl, H2SO4, HF, HNO3
- 11. Последовательность процессов, происходящих при электролитической диссоциации: Ориентация молекул – диполей воды около ионов; Гидратация (взаимодействие) молекул
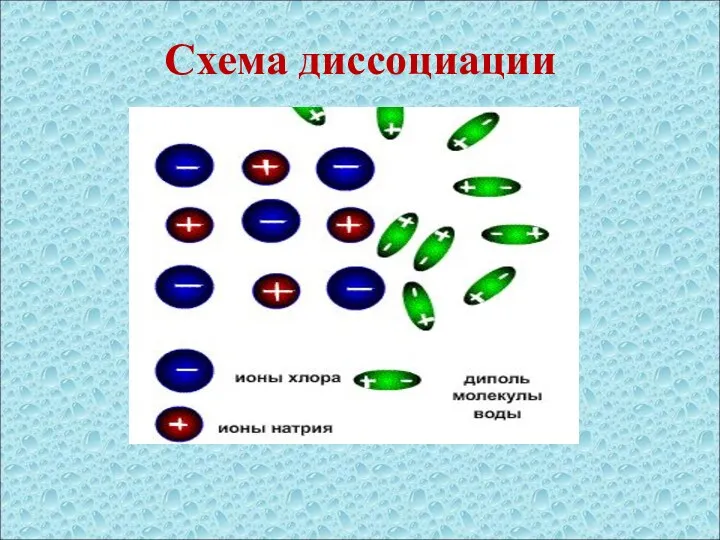
- 12. Схема диссоциации
- 13. Уравнение реакции: NaCl = Na+ + Cl- NaCl – молекула хлорида натрия Na+ - ион натрия
- 14. Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных частиц
- 15. Степень диссоциации выражают в долях или процентах. При ά = 0 диссоциация отсутствует При ά =
- 16. Электролиты Сильные все растворимые соли; сильные кислоты H2SO4, HCl, HNO3 все щелочи NaOH, KOH Слабые слабые
- 17. Основные положения теории электролитической диссоциации
- 19. В предложенных горизонтальных рядах исключите лишнее вещество, то есть, такое, которое не образует с остальными однородную
- 21. Скачать презентацию















 Figure
Figure Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева
Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева Алкалоиды, производные тропана
Алкалоиды, производные тропана Задачи по химии
Задачи по химии Степень окисления
Степень окисления Жидкостная хроматография
Жидкостная хроматография Азотовмисні та елементоорганічні сполуки
Азотовмисні та елементоорганічні сполуки Общая характеристика элементов V-А-группы. Азот
Общая характеристика элементов V-А-группы. Азот Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы Нітроген
Нітроген Коррозия металлов и способы защиты от неё. (11 класс)
Коррозия металлов и способы защиты от неё. (11 класс) Атом. Будова атома
Атом. Будова атома Поляризация электродов
Поляризация электродов Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Оксиды азота
Оксиды азота Базовое нефтехимическое сырье
Базовое нефтехимическое сырье Устойчивость дисперсных систем
Устойчивость дисперсных систем Виды химической связи
Виды химической связи Неорганические полимеры
Неорганические полимеры Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Обобщение по теме Основные классы неорганических веществ. 8 класс
Обобщение по теме Основные классы неорганических веществ. 8 класс Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Диеновые углеводороды или алкадиены (тема 4)
Диеновые углеводороды или алкадиены (тема 4) Растворы. Реакции ионного обмена. Гидролиз солей
Растворы. Реакции ионного обмена. Гидролиз солей Взрывоопасные грузы
Взрывоопасные грузы Предпосылки открытия периодического закона
Предпосылки открытия периодического закона Складання рівнянь окисно-відновних реакцій. Метод електронного балансу
Складання рівнянь окисно-відновних реакцій. Метод електронного балансу Классы неорганических веществ. Лекция №2
Классы неорганических веществ. Лекция №2