Содержание
- 2. * Поверхностные явления (ПЯ) – это особенности поведения веществ, которые наблюдаются на поверхности раздела фаз, и
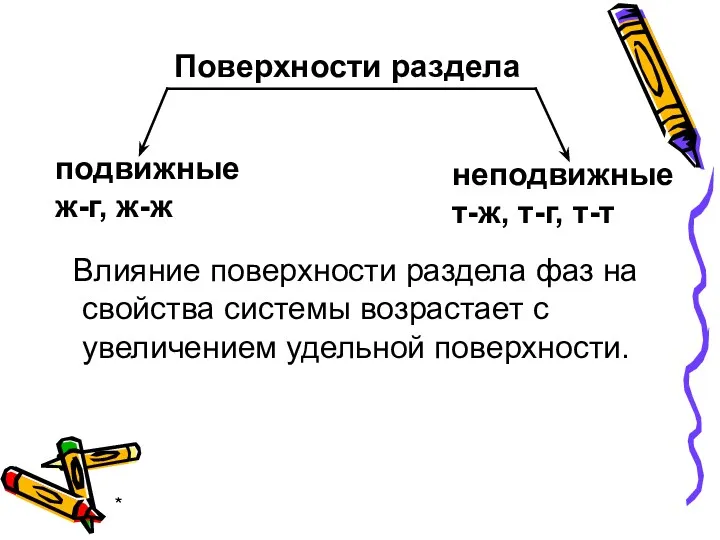
- 3. * Поверхности раздела подвижные ж-г, ж-ж неподвижные т-ж, т-г, т-т Влияние поверхности раздела фаз на свойства
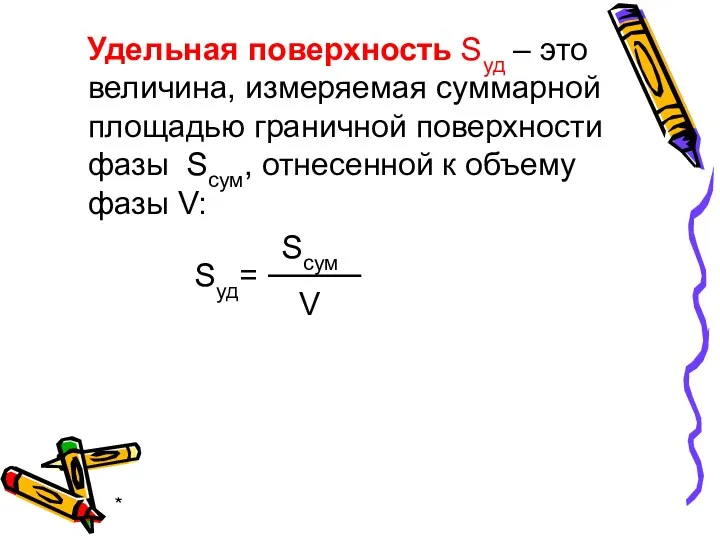
- 4. * Удельная поверхность Sуд – это величина, измеряемая суммарной площадью граничной поверхности фазы Scум, отнесенной к
- 5. *
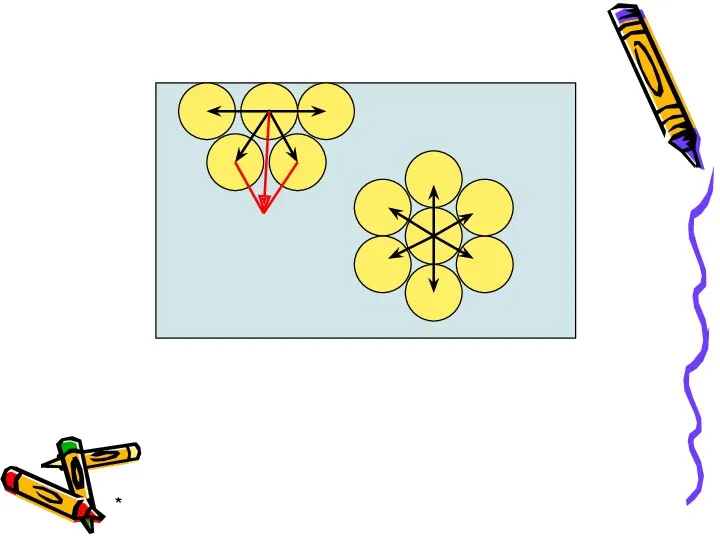
- 6. * Для молекул внутри жидкости равнодействующая всех сил = нулю. Для молекул на границе раздела фаз
- 7. * Свободная поверхностная энергия GS – термодинамическая функция, характеризующая энергию межмолекулярного взаимодействия частиц на поверхности раздела
- 8. * Поверхностное натяжение σ - это величина, численно равная работе, которую необходимо совершить для образования единицы
- 9. * Капли воды на гидрофобной поверхности
- 10. * σ биологических жидкостей используют в диагностике. σ плазмы крови различно при различных заболеваниях. С возрастом
- 11. * Недостаток сурфактанта в легких – причина гибели недоношенных детей (cурфактанты легких – это фосфолипидно-белковые комплексы,
- 12. * Поверхностная активность g – это способность растворенного вещества изменять поверхностное натяжение: ∆σ - изменение поверхностного
- 13. * По способности изменять поверхностное натяжение растворов по сравнению с чистым растворителем все вещества делятся на
- 14. * 1. Поверхностно-активные вещества (ПАВ) (σр-ра
- 15. * 2. Поверхностно-инактивные вещества (ПИВ) (σр-ра> σ0), концентрация растворенных веществ в поверхностном слое меньше, чем в
- 16. * 3. Поверхностно неактивные вещества (ПНВ) практически не изменяют поверхностного натяжения растворителя (σр-ра= σ0) (сахароза, и
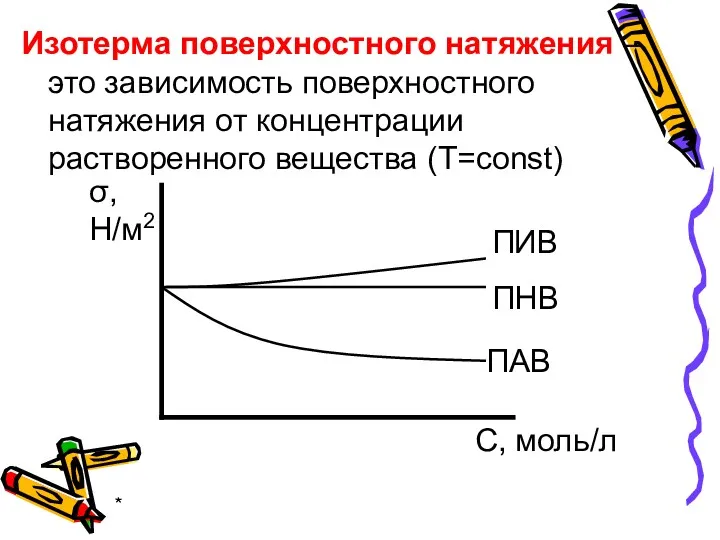
- 17. * Изотерма поверхностного натяжения – это зависимость поверхностного натяжения от концентрации растворенного вещества (Т=const) σ, H/м2
- 18. * В состав организмов входит множество ПАВ: соли жирных кислот, желчные кислоты и их соли, фосфолипиды…
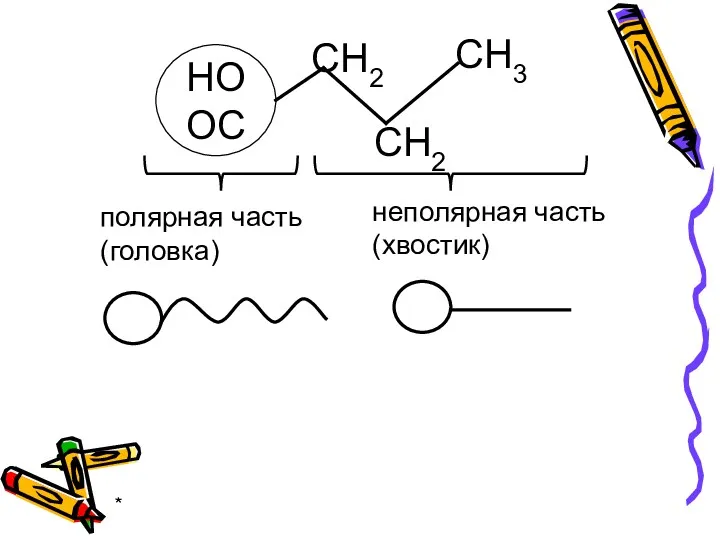
- 19. * ПАВ - дифильны полярная часть (головка) неполярная часть (хвостик)
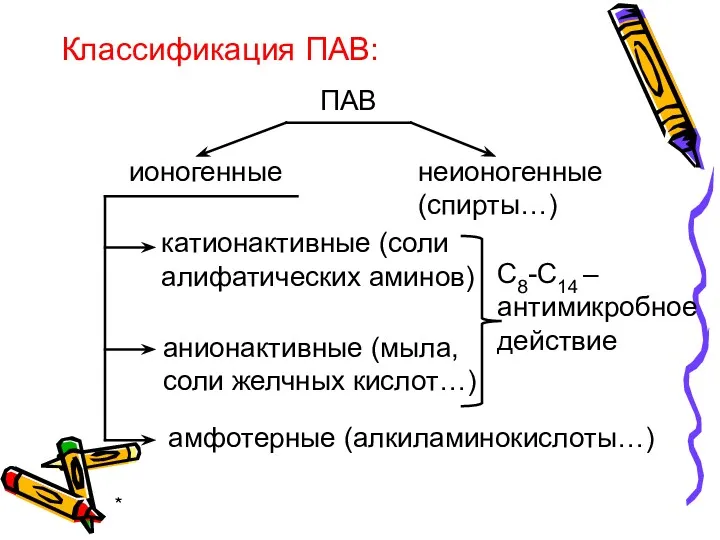
- 20. * Классификация ПАВ: ПАВ ионогенные неионогенные (спирты…) катионактивные (соли алифатических аминов) анионактивные (мыла, соли желчных кислот…)
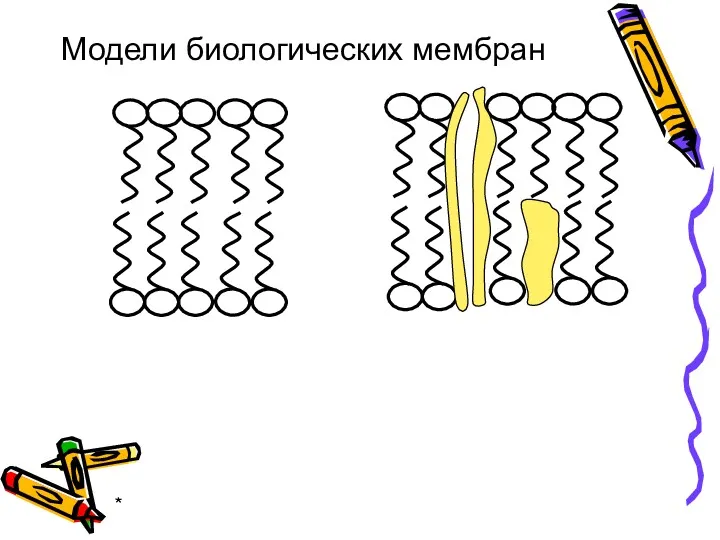
- 21. * Модели биологических мембран
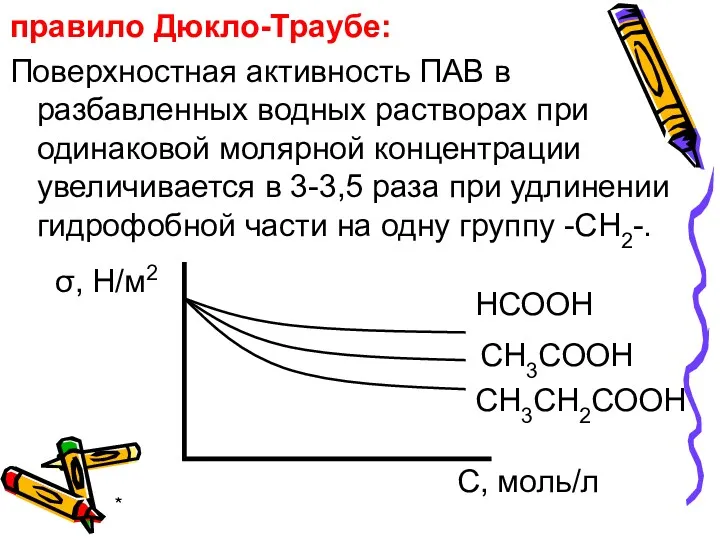
- 22. * правило Дюкло-Траубе: Поверхностная активность ПАВ в разбавленных водных растворах при одинаковой молярной концентрации увеличивается в
- 23. * ПЯ: физическая сорбция: абсорбция, адсорбция, десорбция, капиллярная конденсация хемосорбция
- 24. * Сорбция – поглощение газов, паров или растворенных веществ (сорбатов) твердым телом или жидкостью (сорбентом) Абсорбция
- 25. * Капилярная конденсация – процесс сжижения пара в порах твердого сорбента при снижении Т ниже критической
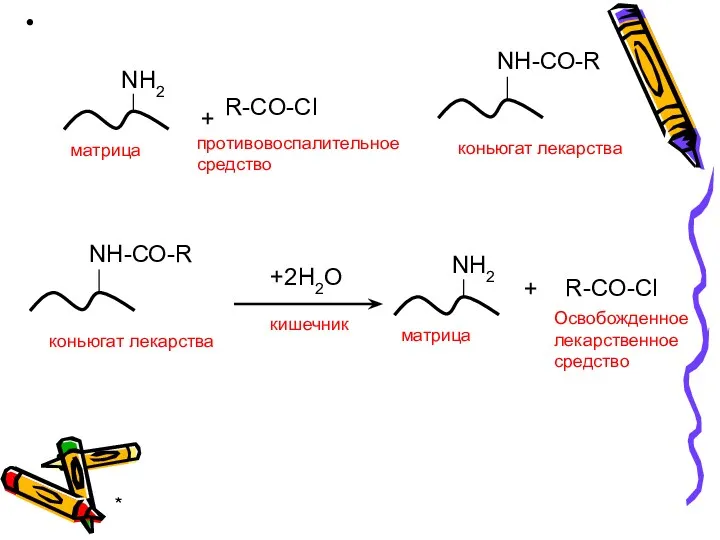
- 26. * Метод хемосорбции используется для создания лекарственных форм с замедленным высвобождением активного вещества (обеспечивает равномерное высвобождение
- 27. *
- 28. * Адсорбция молекул на твердых адсорбентах зависит от: природы адсорбента, природы растворителя, природы поглощаемого вещества, концентрации
- 29. * гидрофильные адсорбенты (силикагель, глины, пористые стекла) поглощают полярные вещества гидрофобные адсорбенты (сажа, активированный уголь) поглощают
- 30. * Влияние природы поглощаемого вещества определяется правилами: «подобное взаимодействует с подобным», правило Шилова: чем больше растворимость
- 31. * правило Ребиндера (правило выравнивания полярностей контактирующих фаз): на полярных адсорбентах лучше адсорбируются полярные адсорбаты из
- 32. * С повышением температуры адсорбция уменьшается. Влияние концентрации растворенного вещества на процесс адсорбции из раствора при
- 33. * Изотерма адсорбции Гиббса Изотерма адсорбции Френдлиха Изотерма адсорбции Ленгмюра Γ = Г∞· К·С 1+К·С
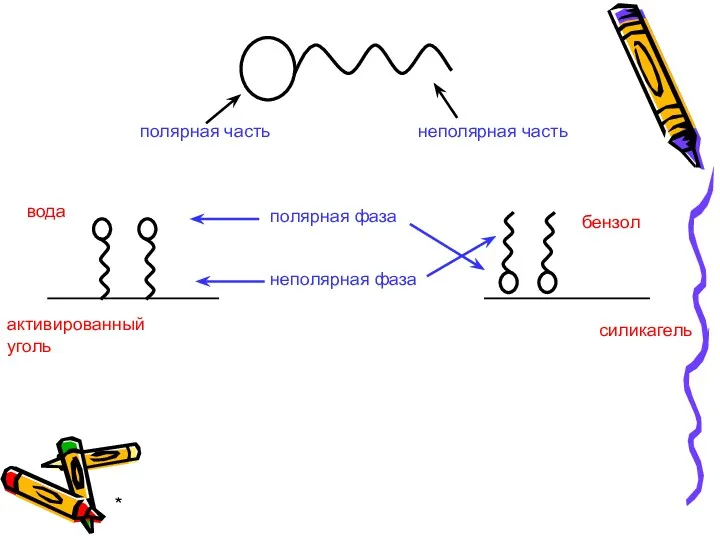
- 34. * При адсорбции ПАВ полярный фрагмент всегда обращен к полярной (гидрофильной) фазе – к воде, силикагелю,
- 35. * силикагель бензол полярная фаза неполярная фаза вода активированный уголь
- 36. * Ионная адсорбция - адсорбция ионов из растворов электролитов на полярных адсорбентах. Ионнообменная + избирательная
- 37. * Особенности ионной адсорбции: на границе раздела фаз возникает ДЭС; скорость ионной адсорбции ионная адсорбция не
- 38. * адсорбируемость иона увеличивается с увеличением радиуса негидратированного иона и увеличением абсолютной величины заряда иона (исключение
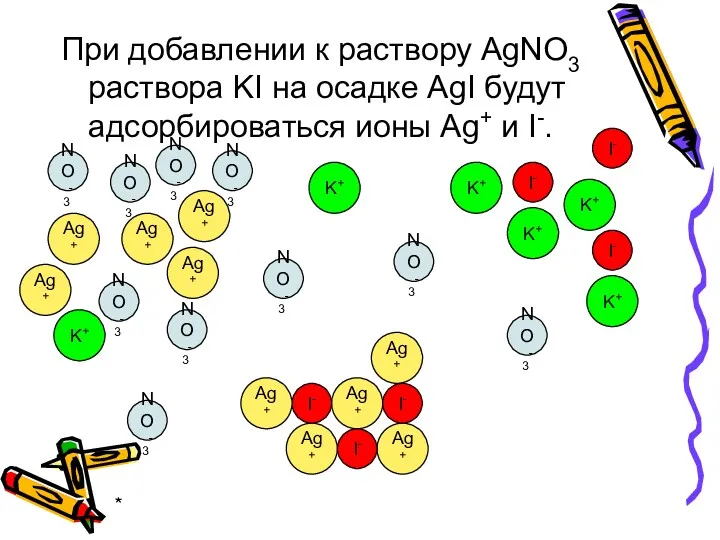
- 39. * Правило Панета-Фаянса: на поверхности кристалла преимущественно адсорбируются те ионы, которые входят в состав кристаллической решетки
- 40. * При добавлении к раствору AgNO3 раствора KI на осадке AgI будут адсорбироваться ионы Ag+ и
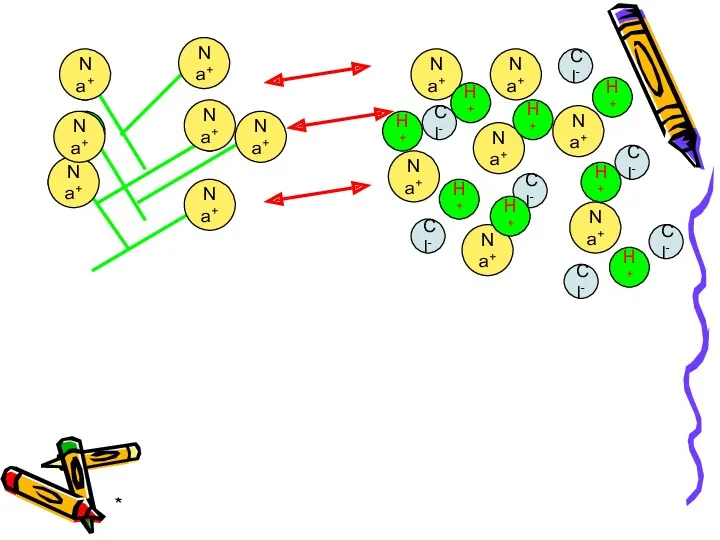
- 41. * Ионообменная адсорбция (ИА) - процесс эквивалентного обмена собственных ионов нерастворимого адсорбента (ионита), посылаемого в раствор,
- 42. * H+ H+ H+ H+ H+ H+ H+ катионит раствор Na+ Na+ Na+ Na+ Na+ Na+
- 43. * Иониты = аниониты + катиониты На ИА основана хроматография – метод определения и разделения веществ
- 45. Скачать презентацию






























 Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Кафедры биохимии УГМУ в прошлом и настоящем
Кафедры биохимии УГМУ в прошлом и настоящем Комплексные соединения
Комплексные соединения Особенности сжигания газообразного топлива и топливосжигающие устройства
Особенности сжигания газообразного топлива и топливосжигающие устройства Тканые армирующие наполнители
Тканые армирующие наполнители Соли. Классификация и свойства солей
Соли. Классификация и свойства солей Технология производства бутилкаучука
Технология производства бутилкаучука Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Брейн – ринг. Мини – ЕГЭ по химии
Брейн – ринг. Мини – ЕГЭ по химии Природні джерела вуглеводнів. Нафта
Природні джерела вуглеводнів. Нафта Химическая кинетика и катализ механики. (Лекция 5)
Химическая кинетика и катализ механики. (Лекция 5) АТФ Аденозинтрифосфат
АТФ Аденозинтрифосфат циклоалканы170
циклоалканы170 Түсті металдар
Түсті металдар Использование информационных технологий при обучении химии
Использование информационных технологий при обучении химии Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Кристалдардың ішкі құрылымы
Кристалдардың ішкі құрылымы Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Полимеры. Протезы трахеи
Полимеры. Протезы трахеи Спирти. Класифікація спиртів. Властивості одноатомних спиртів
Спирти. Класифікація спиртів. Властивості одноатомних спиртів Кислоты. Классификация кислот
Кислоты. Классификация кислот Геометрическая кристаллография
Геометрическая кристаллография Виды присадок к моторным топливам
Виды присадок к моторным топливам Хімія металургійних процесів. Теорія сплавів
Хімія металургійних процесів. Теорія сплавів Переходный элемент алюминий. Свойства алюминия
Переходный элемент алюминий. Свойства алюминия Причина отказа повреждений технологического оборудования и принятия мер по их устранению установки производства газовой серы
Причина отказа повреждений технологического оборудования и принятия мер по их устранению установки производства газовой серы Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Растворы. Лекция №5
Растворы. Лекция №5