Слайд 2

План лекции:
Использование ОВР в аналитической химии.
Типы ОВР.
Количественное описание ОВР.
Константа равновесия
ОВР.
Устойчивость водных растворов окислителей и восстановителей.
Слайд 3

Использование ОВР в аналитической химии
При пробоподготовке для переведения в раствор пробы.
Для
разделения смеси ионов.
Для маскирования.
Для проведения реакций обнаружения катионов и анионов в качественном химическом анализе.
В титриметрическом анализе.
В электрохимических методах анализа.
Слайд 4

Например, при гипоксии (состояние кислородного голодания) происходит замедление транспорта Н+ и
е – в дыхательной цепи и накопление восстановленных форм соединений. Этот сдвиг сопровождается снижением ОВ потенциала (ОВП) ткани и по мере углубления ишемии (местное малокровие, недостаточное содержание крови в органе или ткани) ОВП снижается. Это связано как с угнетением процессов окисления вследствие недостатка кислорода и нарушения каталитической способности окислительно-восстановительных ферментов, так и с активацией процессов восстановления в ходе гликолиза.
Слайд 5

Типы ОВР
1. Межмолекулярные – изменяются степени окисления (С.О.) атомов элементов, входящих
в состав разных веществ:
Слайд 6

2. Внутримолекулярные – окислитель и восстановитель - атомы одной молекулы:
Слайд 7

3. Самоокисления – самовосстановления (диспропорционирования) – один и тот же элемент
повышает и понижает С.О.
Cl2 - является окислителем и восстановителем.
Слайд 8

Количественное описание ОВР
Например, чем сильнее основание, тем больше его сродство в
протону. Также и сильный окислитель обладает большим сродством к электрону.
Например, в кислотно-основных реакциях участвует растворитель (вода), отдавая и принимая протон, а в ОВР вода тоже может терять или присоединять электрон.
Например, для проведения кислотно-основных реакций необходимы как кислота, так и основание, а в ОВР – и окислитель и восстановитель.
Слайд 9

Рассматривая ОВ пару в целом, можно записать схематичное уравнение реакции:
Ox +
nē = Red
Равновесие в растворе можно описать с помощью равновесного потенциала, который зависит от состава раствора по уравнению Нернста:
Слайд 10

При температуре 298 К уравнение Нернста принимает вид:
Слайд 11
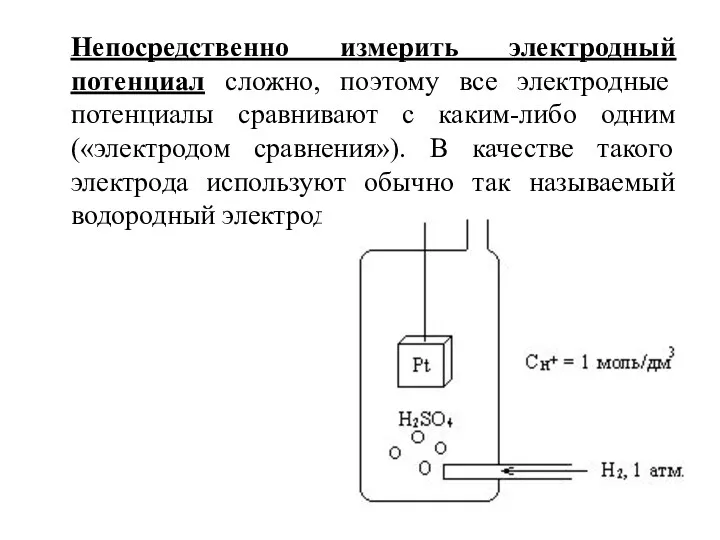
Непосредственно измерить электродный потенциал сложно, поэтому все электродные потенциалы сравнивают с
каким-либо одним («электродом сравнения»). В качестве такого электрода используют обычно так называемый водородный электрод.
Слайд 12

В уравнении Нернста можно использовать вместо активностей ионов их концентрации, но
тогда необходимо знать коэффициенты активностей ионов:
Слайд 13

На силу окислителя и восстановителя могут влиять:
значение рН,
реакции осаждения
реакции комплексообразования.
Тогда свойства редокс-пары будут описываться реальным потенциалом.
Слайд 14

Для расчета реального потенциала полуреакций, получаемых сочетанием
ОВР и реакций осаждения,
используются формулы:
∙ если окисленная форма представляет собой малорастворимое соединение:
Слайд 15

∙ если восстановленная форма представляет собой малорастворимое соединение:
Слайд 16

Сочетание ОВР и реакций комплексообразования
∙ если окисленная форма связана в комплекс:
Слайд 17

∙ если восстановленная форма связана в комплекс:
Слайд 18
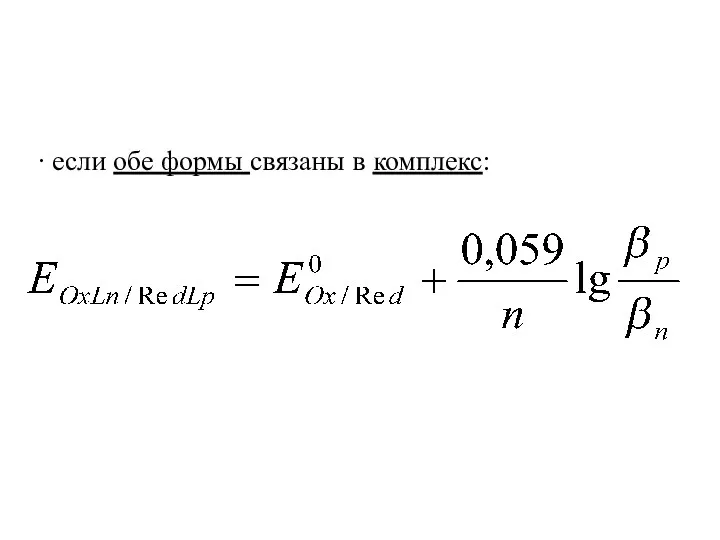
∙ если обе формы связаны в комплекс:
Слайд 19

Сочетание ОВР и реакций протонирования
если протонируется окисленная форма:
Слайд 20

если протонируется восстановленная форма:
Слайд 21

если протонируются обе формы:
Слайд 22

если реакция протекает по следующему уравнению:
Ox + mH+ + nē
= Red + H2O
тогда
Слайд 23

Константа равновесия ОВР
Расчет константы равновесия для реакции:
Sn2+ + 2Fe3+ = Sn4+
+ 2Fe2+
Константа равновесия рассчитывается:
Слайд 24

Выражения для реальных ОВ потенциалов каждой редокс-пары будут выглядеть следующим образом:
Слайд 25

Слайд 26

Проведя математические операции, получим:
К = 1021
Слайд 27

Используя приведенное вычисление константы равновесия, получим для любого обратимого ОВ процесса
при 20 0С следующее уравнение:
Слайд 28

Например, в цериметрии (окислитель Се4+):
Fe2+ + Се4+ = Fe3+ + Се3+
К = 1011,4 = 2,3 · 1011
















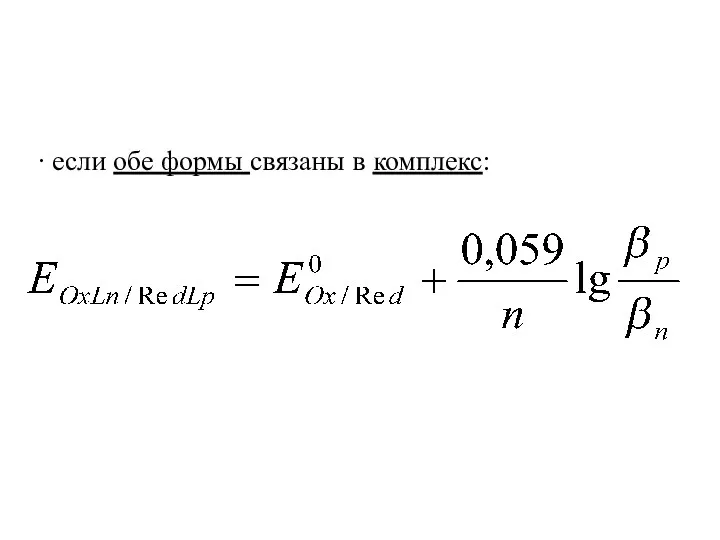










 Рекомендации по использованию пластмасс в быту. Опасные типы пластмасс
Рекомендации по использованию пластмасс в быту. Опасные типы пластмасс Химические волокна
Химические волокна Кристаллическое состояние вещества в природе
Кристаллическое состояние вещества в природе Учение о растворах. Фазовые равновесия
Учение о растворах. Фазовые равновесия Дослідження оптичних властивостей нематичних рідких кристалів допованих Оксидом церію IV (СеО2)
Дослідження оптичних властивостей нематичних рідких кристалів допованих Оксидом церію IV (СеО2) Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля
Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля Твердые вещества
Твердые вещества Металлы; их классификация, строения и свойства
Металлы; их классификация, строения и свойства Обобщающий урок по теме: Металлы
Обобщающий урок по теме: Металлы Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Цветные сплавы
Цветные сплавы Законы химии
Законы химии Натуральный каучук
Натуральный каучук Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16)
Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16) Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений Роль химии в жизни человека
Роль химии в жизни человека Карбоновые кислоты. Свойства карбоновых кислот
Карбоновые кислоты. Свойства карбоновых кислот Формы природных выделений минералов. Занятие 2
Формы природных выделений минералов. Занятие 2 Соединения железа
Соединения железа Органические соединения амины
Органические соединения амины Тотығу-тотықсыздану реакциялары
Тотығу-тотықсыздану реакциялары Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Химия. D-элементтер
Химия. D-элементтер Тема 2
Тема 2 Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Кривые титрования: построение и анализ (лекция 6)
Кривые титрования: построение и анализ (лекция 6) Методы получения нанопорошков
Методы получения нанопорошков