Содержание
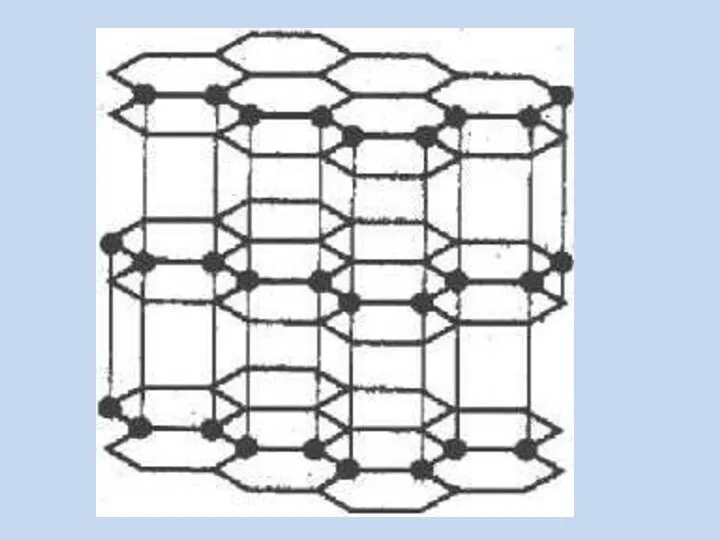
- 2. Вспомним изученное – Подберите названия к иллюстрациям
- 11. Рассмотреть строение, получение, химические свойства и применение оксидов углерода; Выявить биологическое действие изучаемых веществ на живые
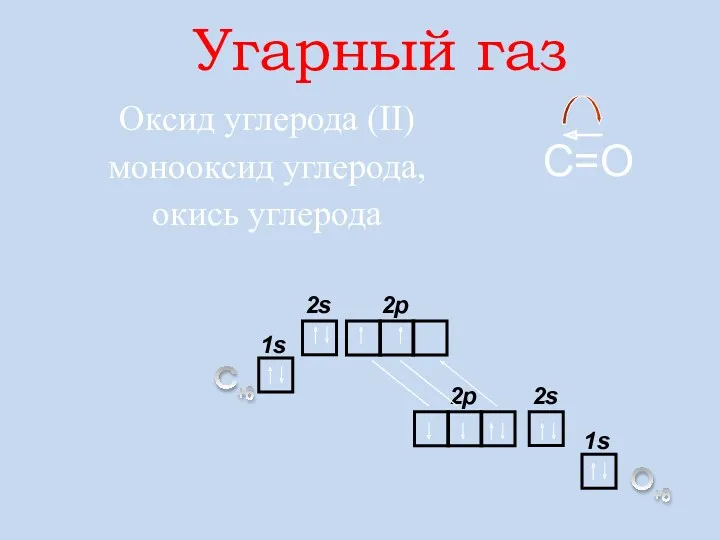
- 12. Угарный газ Оксид углерода (II) монооксид углерода, окись углерода С +6 О +8 s 2 С=О
- 13. ПДК (СО) = 20 мг/м3 Угарный газ – ядовитое вещество! 2С + О2 = 2СО СО2
- 14. Мr(СО) = 28 2СО + О2 = 2СО2 Цвета, запаха не имеет. В воде нерастворим. СО
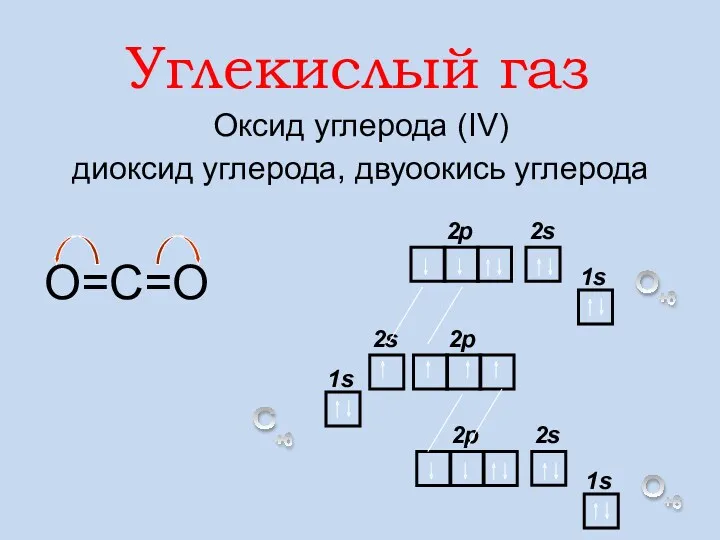
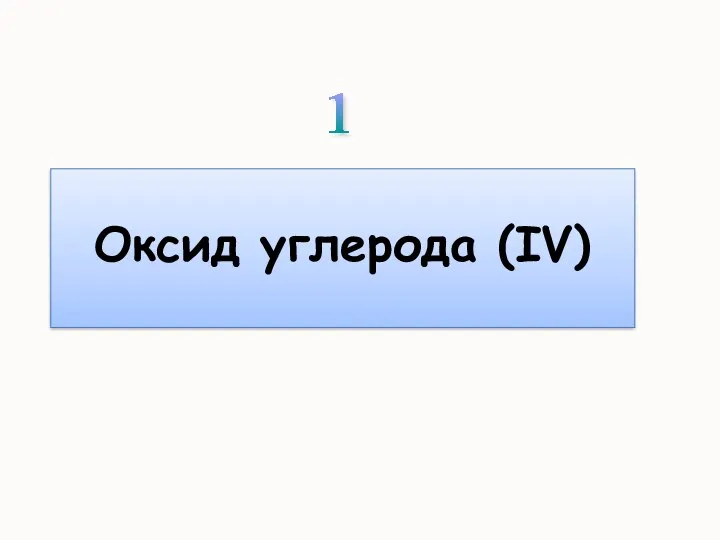
- 15. Углекислый газ Оксид углерода (IV) диоксид углерода, двуоокись углерода О=С=О
- 16. ПДК (СО2) = 30 мг/м3 Углекислый газ — условно ядовитое вещество С + О2 = СО2
- 17. Мr(СО2) = 44 Цвета, запаха не имеет. Хорошо растворяется в воде. Не поддерживает горение Вызывает помутнение
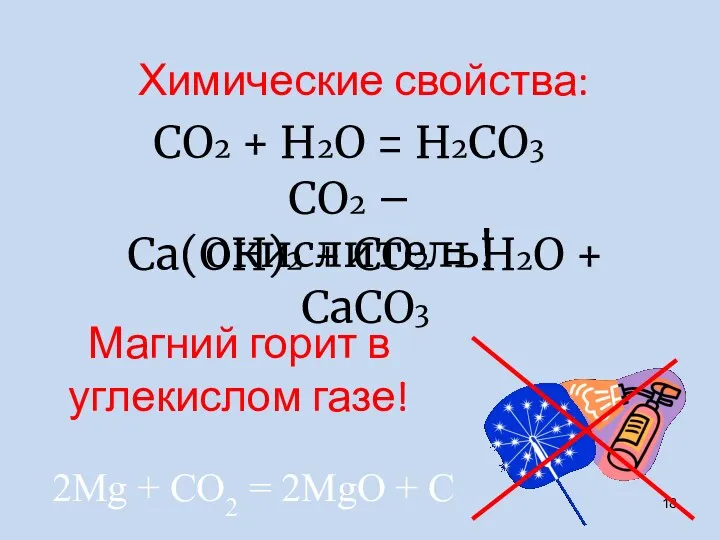
- 18. СО2 + H2О = H2СО3 СО2 – окислитель! Са(ОН)2 + СО2 = H2О + СаСО3 2Мg
- 19. 1 вариант Фамилия:_______ Углекислый газ . . . . . . . 1 2 3 4
- 20. Оксид углерода (IV) 1
- 21. СO 2
- 22. Окислитель 3
- 23. Не имеет запаха 4
- 24. Растворим в воде 5
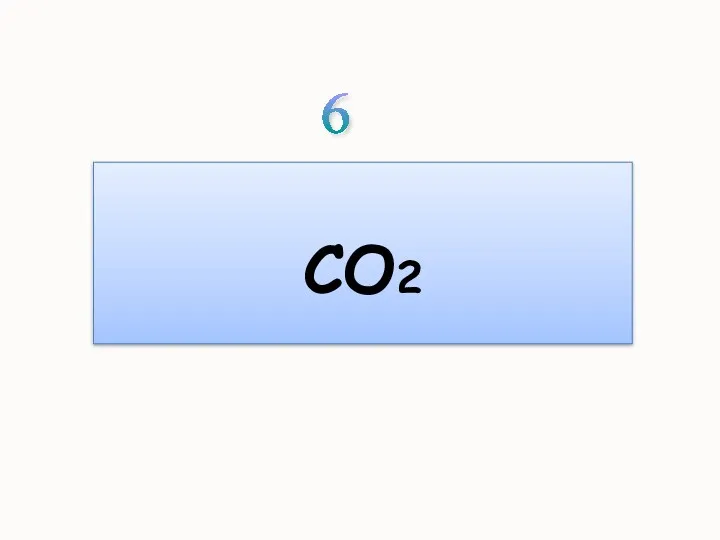
- 25. СO2 6
- 26. Восстановитель 7
- 28. Скачать презентацию



















 Благородные металлы
Благородные металлы Взаємодія кисню із складними речовинами
Взаємодія кисню із складними речовинами Пироксены. Группа пироксенов
Пироксены. Группа пироксенов Номенклатура органических соединений
Номенклатура органических соединений Адсорбция
Адсорбция Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Поверхностно-активные вещества и их роль
Поверхностно-активные вещества и их роль Искусственные каменные материалы
Искусственные каменные материалы Электролиз водных растворов
Электролиз водных растворов Ртуть (Hydrargyrum, жидкое серебро)
Ртуть (Hydrargyrum, жидкое серебро) Активационный анализ
Активационный анализ Кислородсодержащие органические соединения- спирты. 10 класс
Кислородсодержащие органические соединения- спирты. 10 класс 20231228_himicheskiy_sostav_kletki_wecompress.com_
20231228_himicheskiy_sostav_kletki_wecompress.com_ Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома Подготовительные курсы для абитуриентов химического факультета БГУ
Подготовительные курсы для абитуриентов химического факультета БГУ Твердые вещества
Твердые вещества Железоуглеродистые сплавы
Железоуглеродистые сплавы НЕМЕТАЛЛЫ 9 класс ОБЩИЕ СВЕДЕНИЯ
НЕМЕТАЛЛЫ 9 класс ОБЩИЕ СВЕДЕНИЯ Растворы. Термодинамическая теория растворов
Растворы. Термодинамическая теория растворов Спирты. Строение. Химические и физические свойства, получение и применение спиртов
Спирты. Строение. Химические и физические свойства, получение и применение спиртов Задачи на вывод формулы органических веществ
Задачи на вывод формулы органических веществ Теоретическое и прикладное материаловедение. Занятие 2
Теоретическое и прикладное материаловедение. Занятие 2 Воспламенение (зажигание) газовых смесей
Воспламенение (зажигание) газовых смесей Состав, свойства и роль молока в жизни человека
Состав, свойства и роль молока в жизни человека Непредельные углеводороды
Непредельные углеводороды Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты
Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты Алкины
Алкины Комплексные (или координационные) соединения
Комплексные (или координационные) соединения