Содержание
- 2. Основные понятия темы Химический элемент – это вид атомов с одинаковым зарядом ядра. Химическое соединение –
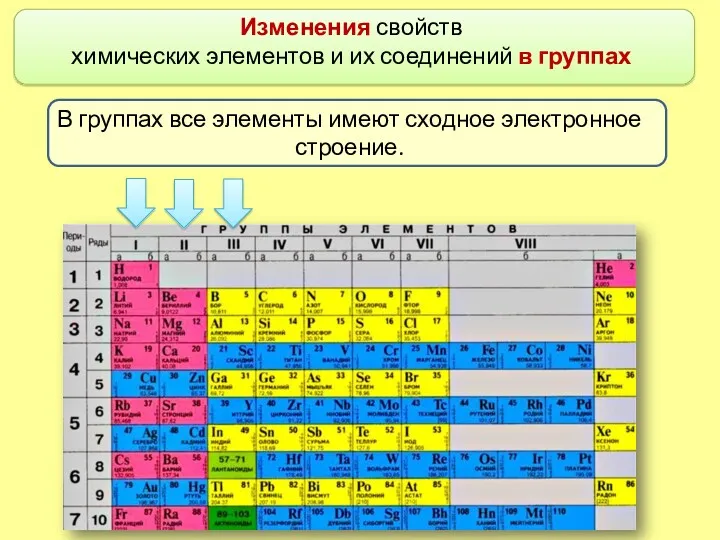
- 3. Изменения свойств химических элементов и их соединений в группах В группах все элементы имеют сходное электронное
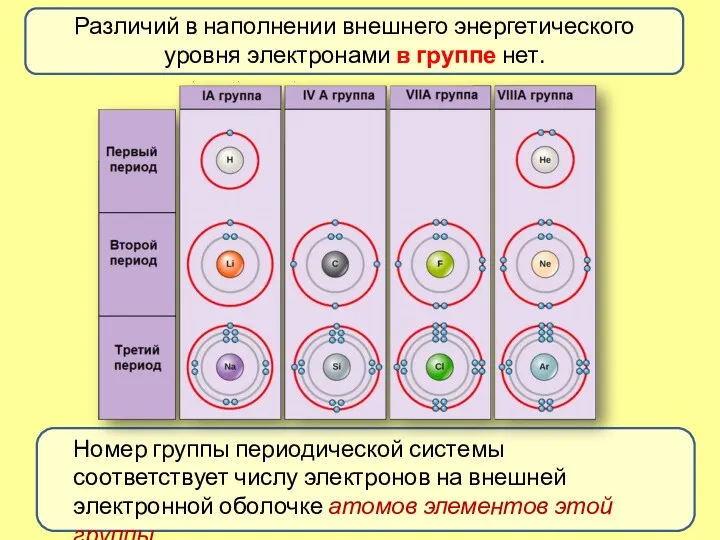
- 4. Различий в наполнении внешнего энергетического уровня электронами в группе нет. Номер группы периодической системы соответствует числу
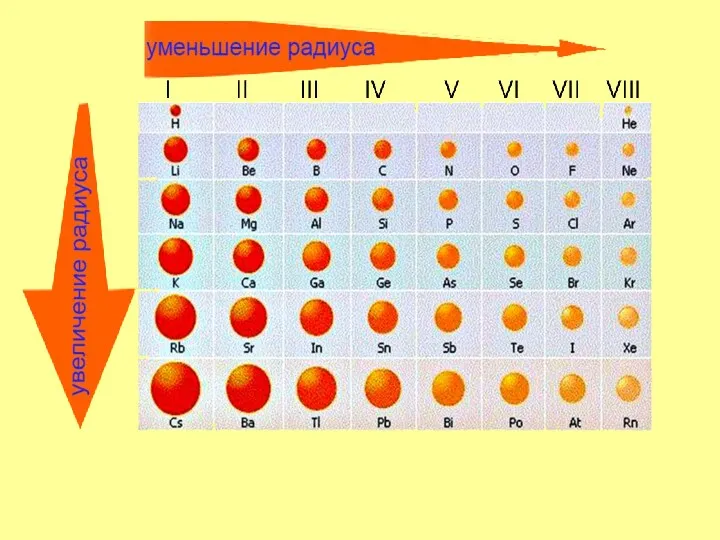
- 5. Меняется размер атома - сверху вниз в группе радиусы атомов увеличиваются! Периодический закон Д. И. Менделеева:
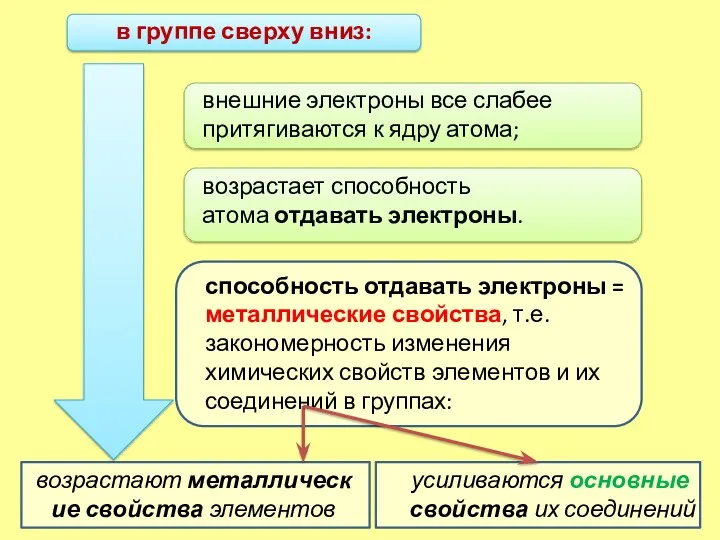
- 6. в группе сверху вниз: усиливаются основные свойства их соединений внешние электроны все слабее притягиваются к ядру
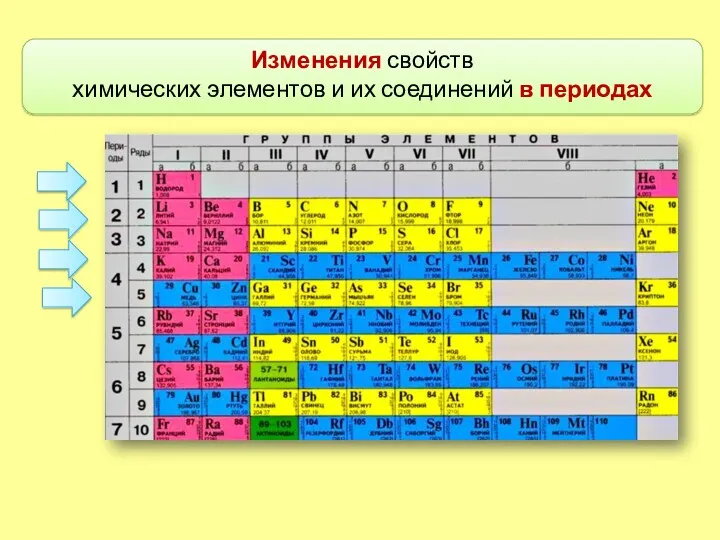
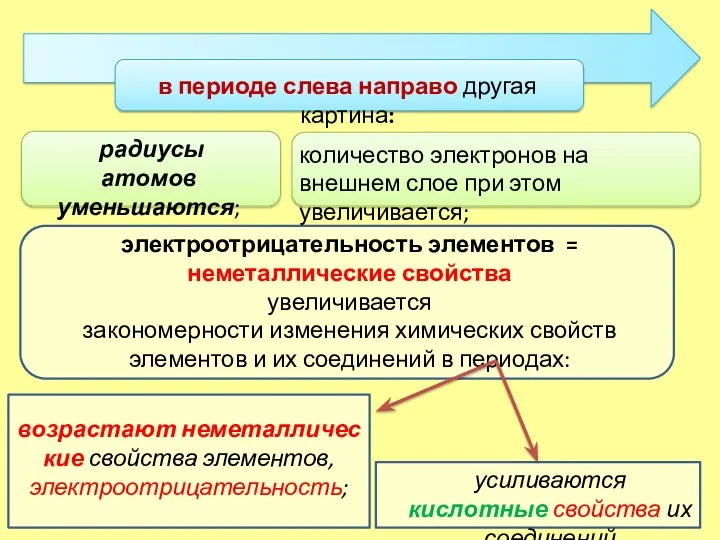
- 7. Изменения свойств химических элементов и их соединений в периодах
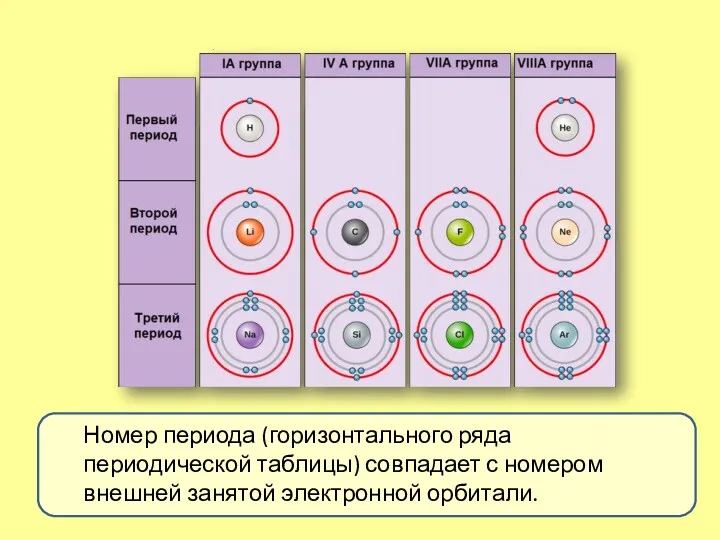
- 8. Номер периода (горизонтального ряда периодической таблицы) совпадает с номером внешней занятой электронной орбитали.
- 9. в периоде слева направо другая картина: усиливаются кислотные свойства их соединений радиусы атомов уменьшаются; количество электронов
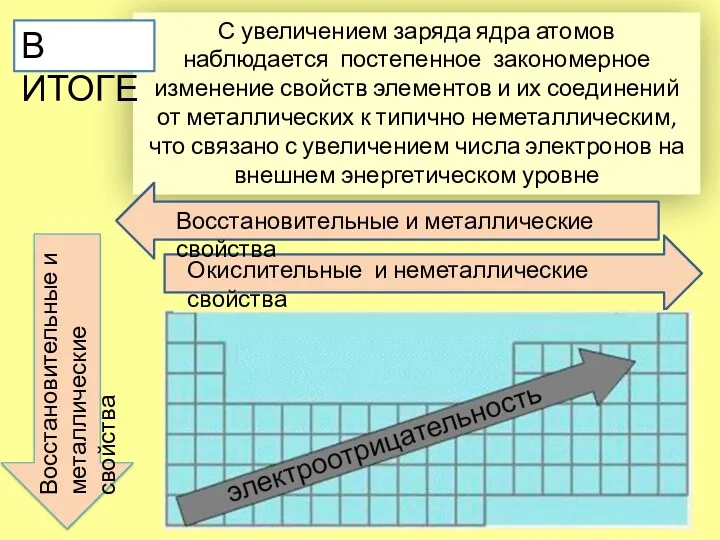
- 11. С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических
- 12. Zn Cr Al Sn Pb Mn Fe Be Есть еще элементы, которые образуют так называемые амфотерные
- 13. Закрепление материала Задание №1: Сравните металлические свойства элементов, поставив вместо ☺ знак « »: Na ☺
- 14. Проверьте себя: Сравните металлические свойства элементов, поставив вместо ☺ знак « »: Na Sr; Na >
- 15. Задание №2: Расположите элементы в порядке уменьшения их металлических свойств: а) Al, Na, K, B, Bа,
- 16. Проверьте себя: Расположите элементы в порядке уменьшения их металлических свойств: а) K > Bа > Nа
- 17. Домашнее задание: Изучить §41, по данной презентации сделать конспект и выполнить тест (смотри ниже!!!), ответы на
- 18. В ряду Li → Ве → В → С А усиливаются восстановительные свойства простых веществ Б
- 19. 2. Усиление металлических свойств элементов представлено в ряду: А N → Р → As Б S
- 20. 3. Электронную конфигурацию 1s(2)2s(2)2р(6)3s(2)Зр(6)4S(0) имеет ион А Ca(0) Б Al(3+) В Cs(+) Г K(+)
- 21. 4. В каком ряду кислотность соединений возрастает А Cr(0), Cr(3+), Cr(+6) Б Mn(+6), Mn(+4), Mn(+2) В
- 22. 5. Как изменяются кислотные свойства оксидов хрома в ряду: CrO - Cr2O3 - CrO3 А основной
- 23. 6. Даны элементы: F, O, N, Cl. Какие утверждения верны? А в заданном ряду элементов электроотрицательность
- 24. 7. Наиболее выражены металлические свойства у: А фософра Б азота В рубидия Г водорода
- 25. 8. Только амфотерные оксиды указаны в ряду: А Na2O, ZnO, CuO Б ZnO, Al2O3, Cr2O3 В
- 26. 9. Выберите правильное утверждение: А - в ряду элементов: Na – Si – Cl неметалличность простых
- 28. Скачать презентацию

















 Средние породы. Типичный андезитовый вулкан
Средние породы. Типичный андезитовый вулкан Учение об агрегатных состояниях вещества. Жидкое состояние. Твердое состояние. Плазма
Учение об агрегатных состояниях вещества. Жидкое состояние. Твердое состояние. Плазма Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров Кремний и его соединения. Нахождение в природе
Кремний и его соединения. Нахождение в природе Неметаллы: общая характеристика
Неметаллы: общая характеристика Гидролиз солей
Гидролиз солей Алкандар,жалпы формуласы, гомологтық қатары, изомерлері, атаулары
Алкандар,жалпы формуласы, гомологтық қатары, изомерлері, атаулары Полимеры, бумага
Полимеры, бумага Залежність фізичних властивостей речовин від типу кристалічних ґраток
Залежність фізичних властивостей речовин від типу кристалічних ґраток Минеральные удобрения
Минеральные удобрения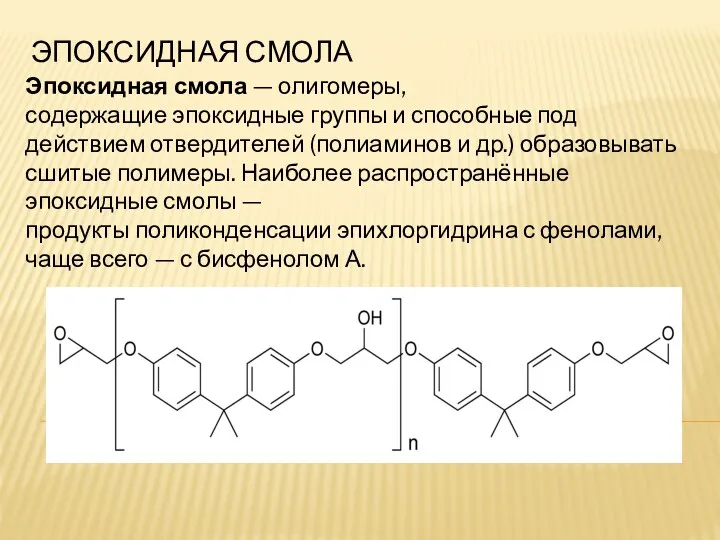 Эпоксидная смола
Эпоксидная смола Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Химия в повседневной жизни человека
Химия в повседневной жизни человека Введение в органическую химию
Введение в органическую химию Ерітіндіден заттарды бөлу әдістері
Ерітіндіден заттарды бөлу әдістері Коллигативные свойства растворов
Коллигативные свойства растворов Коррозия металла. Способы защиты от коррозии
Коррозия металла. Способы защиты от коррозии Техника безопасности и правила работы в лаборатории. 10 класс
Техника безопасности и правила работы в лаборатории. 10 класс Вещества и их превращения Роль химии в нашей жизни
Вещества и их превращения Роль химии в нашей жизни Выделение транс-анетола из эфирных масел
Выделение транс-анетола из эфирных масел Качественные реакции на органические вещества
Качественные реакции на органические вещества Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс Посуда, ее виды и использование
Посуда, ее виды и использование Титриметрические методы количественного определения лекарственных веществ
Титриметрические методы количественного определения лекарственных веществ Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие Неорганические полимеры
Неорганические полимеры Основные классы неорганических соединений
Основные классы неорганических соединений Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты)