Содержание
- 2. «История химии до ХХ века – это история науки о растворах» Поль Вальден
- 3. Обеспечение процессов всасывания и механического передвижения питательных веществ Поддержание оптимального осмотического давления Поддержание температуры тела Среда
- 4. Физическая смесь? нет постоянства состава можно разделить на составные части Химическое соединение? объем не аддитивен изменение
- 5. Агрегатные состояния растворов, применяемых в медицине: а) закись азота и эфир в кислороде (газовый наркоз); б)
- 6. Классификация растворов
- 7. Определение раствора по Д.И.Менделееву: Раствор – это гомогенная физико-химическая система, состоящая из частиц растворителя, растворенного вещества
- 8. Способы выражения концентрации раствора Массовая доля ω = m(р.в-ва)/m(р-ра) Молярная концентрация С = n/ V =
- 9. Растворимость способность вещества растворяться в данном растворителе
- 10. Растворение-процесс самопроизвольный : ΔG ΔG= ΔH - TΔS При растворении твердого вещества в жидкости ΔS>0 ΔHраст.
- 11. «подобное растворяется в подобном» ограниченная растворимость (вода-эфир, вода-хлороформ) неограниченная растворимость (вода-спирт) полная нерастворимость (вода-керосин) ΔНраст. =
- 12. Растворимость газов в жидкостях зависит от: 1) природы газа химическое взаимодействие с водой ( NH3 или
- 13. C = K·P C – молярная концентрация газа в разбавленном растворе (моль/л) K – константа Генри,
- 15. Закон Сеченова (1829 -1905) Растворимость газов в жидкостях в присутствии электролитов понижается ln No\ N =
- 16. Сольватацией (гидратацией) Диссоциацией Гидролизом Процесс растворения может сопровождаться
- 17. Теория Электролитической Диссоциации С. Аррениуса Электролиты – вещества, распадающиеся в растворах или в расплавах на ионы
- 19. Н2О = Н+ + ОН- Константа диссоциации – константа равновесия кН2О = Константа диссоциации К зависит
- 20. C продиссоциированных = _________________ C всех молекул Степень диссоциации α зависит от: Природы растворителя и растворенного
- 21. При α Вывод закона разбавления Оствальда
- 22. Коллигативные свойства растворов Осмотическое давление Давление насыщенного пара растворителя над раствором Температура замерзания растворов Температура кипения
- 23. Осмос односторонняя диффузия молекул растворителя через полупроницаемую мембрану Диффузия – самопроизвольный процесс выравнивания концентрации вещества в
- 24. Осмотическое давление – это давление, которое нужно приложить, чтобы привести раствор в равновесие с чистым растворителем,
- 25. Закон Вант – Гоффа π = См R T П – осмотическое давление (кПа) R –
- 26. i показывает, во сколько раз истинная концентрация кинетически активных частиц в растворе электролита больше, чем в
- 27. Изотонический коэффициент i = 1 для НЕЭЛЕТРОЛИТов i = n для сильных электролитов NaCl Na+ +
- 28. Осмолярная концентрация - суммарное молярное количество всех кинетически активных частиц, содержащихся в 1 литре раствора, независимо
- 30. Изоосмия - постоянство осмотического давления физиологических сред (фундаментальное физико-химическое требование гомеостаза) Изотонические растворы- с одинаковым осмотическим
- 31. Физиологические растворы 0,9%-ный ( 0,15 М ) раствор NаСl и 5% ( 0,3М ) раствор глюкозы
- 32. Закон Рауля (1886) Относительное понижение давления насыщенного пара растворителя над раствором нелетучего неэлектролита пропорционально мольной доле
- 33. Причины Уменьшение Поверхности Испарения Уменьшение Концентрации Растворителя:
- 36. Следствия закона Рауля Повышение температуры кипения раствора по сравнению с температурой кипения чистого растворителя ΔТкип =
- 37. С учетом диссоциации ΔТкип =Ткип.р-ра- Ткип.р-ля ΔТкип =iЕ×Сm Е- эбулиоскопическая постоянная растворителя (кг*К*моль-1) Сm - моляльная
- 38. Моляльность Сm - число моль вещества в 1000 г растворителя (не зависит от температуры, поэтому часто
- 39. 2. Понижение температуры замерзания раствора по сравнению с чистым растворителем ΔТзам.= Тзам.р-ля –Тзам.Р- ра ΔТзам.= iК×Сm
- 40. Экспериментальное определение молекулярной массы: осмометрическое, криометрическое, эбулиометрическое
- 44. Скачать презентацию
 Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Углеводороды
Углеводороды Технологическое проектирование процессов переработки пэн
Технологическое проектирование процессов переработки пэн Алюминий. Строение
Алюминий. Строение Каталитический риформинг бензинов
Каталитический риформинг бензинов Отрицательное влияние азотных минеральных удобрений на почву
Отрицательное влияние азотных минеральных удобрений на почву Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound
Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound Классы неорганических веществ
Классы неорганических веществ Химическая связь. Виды химической связи
Химическая связь. Виды химической связи Химический состав. Закуска
Химический состав. Закуска Хімічні властивості алканів
Хімічні властивості алканів Мир запахов
Мир запахов Чисті речовини і суміші
Чисті речовини і суміші Оксиды. Формулы оксидов ( 8 класс)
Оксиды. Формулы оксидов ( 8 класс) Азотсодержащие органические соединения
Азотсодержащие органические соединения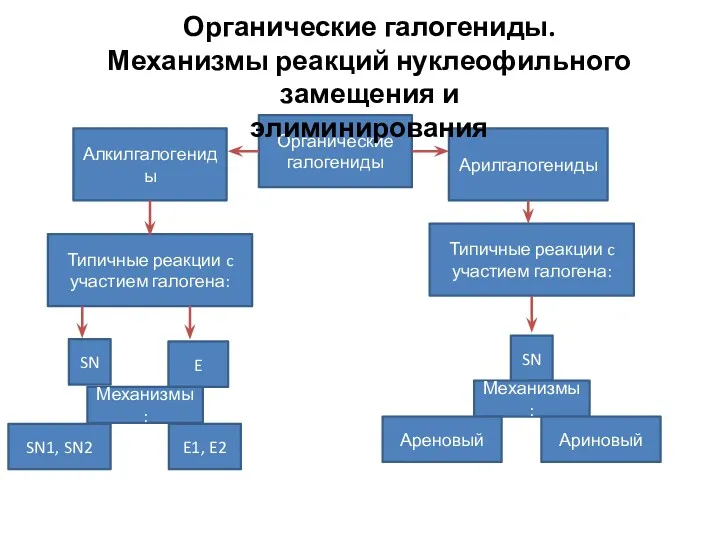
 Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Массовая доля вещества в растворе. Урок химии. 8 класс
Массовая доля вещества в растворе. Урок химии. 8 класс Характерные химические свойства металлов
Характерные химические свойства металлов Химические реакции. Закон сохранения массы веществ
Химические реакции. Закон сохранения массы веществ 20231004_agregatnye_sostoyaniya_-_kopiya
20231004_agregatnye_sostoyaniya_-_kopiya Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Вода – это жизнь!
Вода – это жизнь! Геохимия магматического процесса
Геохимия магматического процесса Открытие новых химических элементов с атомными номерами 113, 115, 117 и 118
Открытие новых химических элементов с атомными номерами 113, 115, 117 и 118 Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі Химия в Великую Отечественную войну
Химия в Великую Отечественную войну Волокнистое сырьё. Технологические и эксплуатационные свойства
Волокнистое сырьё. Технологические и эксплуатационные свойства