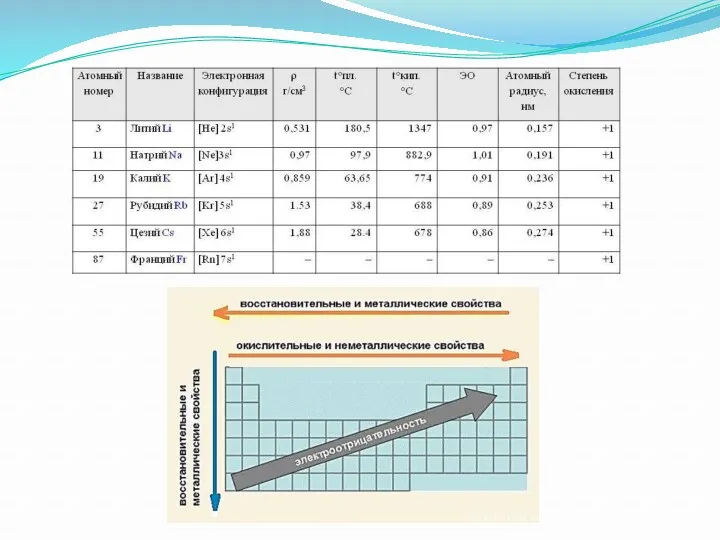
Соединения щелочных металлов
1. Гидроксиды
Для получения гидроксидов щелочных металлов в основном
используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
катод:
анод:
Гидроксиды щелочных металлов при нагревании возгоняются без разложения, за исключением гидроксида лития, который так же, как гидроксиды металлов главной подгруппы II группы, при прокаливании разлагается на оксид и воду:
1. Соли
Важным продуктом, содержащим щелочной металл, является сода Na2CO3. Основное количество соды во всём мире производят по методу Сольве, предложенному ещё в начале XX века. Суть метода состоит в следующем: водный раствор NaCl, к которому добавлен аммиак, насыщают углекислым газом при температуре 26 — 30 °C. При этом образуется малорастворимый гидрокарбонат натрия, называемый питьевой содой:







 Металлы и сплавы с высокой удельной прочностью
Металлы и сплавы с высокой удельной прочностью Типы химических реакций
Типы химических реакций Ұшқыш уларды оқшаулауды теориялық негіздеу
Ұшқыш уларды оқшаулауды теориялық негіздеу Вторичная переработка нефти. Лекция 9
Вторичная переработка нефти. Лекция 9 Растворы
Растворы Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Хром, марганец
Хром, марганец Химические методы синтеза наночастиц
Химические методы синтеза наночастиц Застосування алканів
Застосування алканів Природні джерела вуглеводнів. Нафта
Природні джерела вуглеводнів. Нафта Цинк
Цинк Основные понятия и законы химии. Тема 1
Основные понятия и законы химии. Тема 1 Химические элементы азот и фосфор
Химические элементы азот и фосфор Пластификаторы и пластификация полимеров
Пластификаторы и пластификация полимеров Предмет химии. Вещества
Предмет химии. Вещества Аналитическая химия
Аналитическая химия Неон (Ne)
Неон (Ne) Фосфор и его соединения
Фосфор и его соединения Энергетика химических реакций.(Лекция 8,9)
Энергетика химических реакций.(Лекция 8,9) Задачи
Задачи Виды химической связи
Виды химической связи Химические явления. Горение. 5 класс
Химические явления. Горение. 5 класс Геохимия метасоматтческого процесса. (Лекция 7)
Геохимия метасоматтческого процесса. (Лекция 7) Магнезит
Магнезит Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Атом. Будова атома
Атом. Будова атома Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла