Слайд 2

Химический диктант.
Найди элемент по адресу, укажи его порядковый номер.
1. 2 период,
5 группа главная подгруппа
2. 2 период, 3 группа главная подгруппа
3. 3 период, 2 группа главная подгруппа
4. 5 период, 2 группа побочная подгруппа
5. 2 период, 7 группа главная подгруппа
6. 4 период, 3 группа побочная подгруппа
7. 4 период, 6 группа побочная подгруппа
8. 4 период,4 группа главная подгруппа
9. 4 период, 4 группа побочная подгруппа
10. 7 период, 1 группа главная подгруппа
Слайд 3

Слайд 4

ДЕМОКРИТ
В основе философии Демокрита лежит учение об атомах и пустоте как
двух принципах, порождающих многообразие космоса. Атом есть мельчайшее «неделимое» тело, не подверженное никаким изменениям. Неделимость атома аналогична неделимости «бытия».
Слайд 5

Эрнест Резерфорд в 1911 году предложил планетарную модель атома: В центре
находится положительно заряженное ядро, которое имеет достаточно малые размеры, но в нём заключена почти вся масса атома; вокруг ядра по круговым орбитам движутся отрицательно заряженные электроны, подобно движению планет вокруг солнца.
Слайд 6

1. В центре атома находится положительно заряженное ядро.
2. Весь положительный заряд
и почти вся масса атома находятся в его ядре.
3. Ядра атомов состоят из протонов и нейтронов.
4. Вокруг ядра по замкнутым орбитам вращаются электроны.
Слайд 7

Порядковый номер элемента – это непросто номер по порядку, он имеет
физический смысл.
Слайд 8
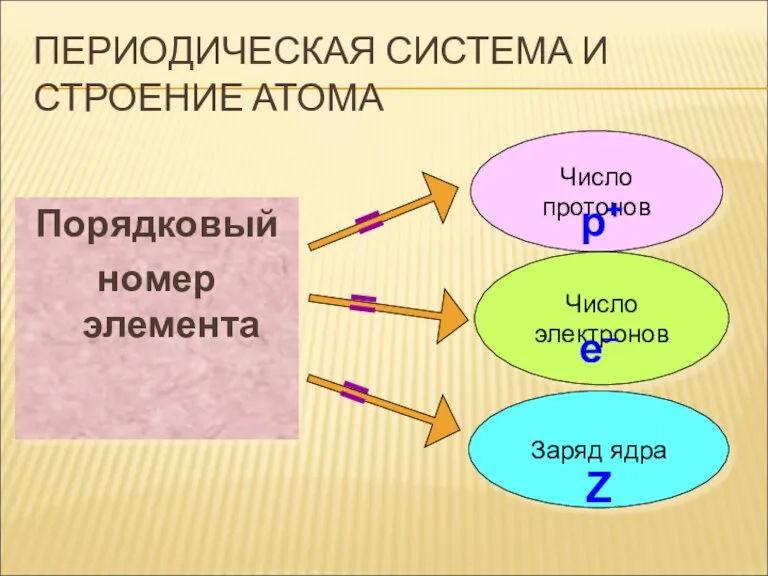
ПЕРИОДИЧЕСКАЯ СИСТЕМА И СТРОЕНИЕ АТОМА
Порядковый
номер элемента
Число протонов
Число электронов
Заряд ядра
р+
е–
Z
=
=
=
Слайд 9
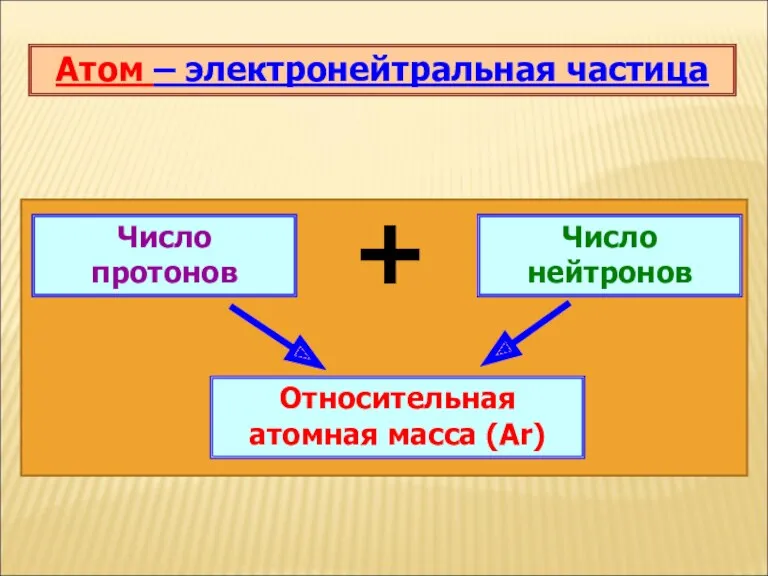
Атом – электронейтральная частица
Число нейтронов
Число протонов
+
Относительная атомная масса (Аr)
Слайд 10
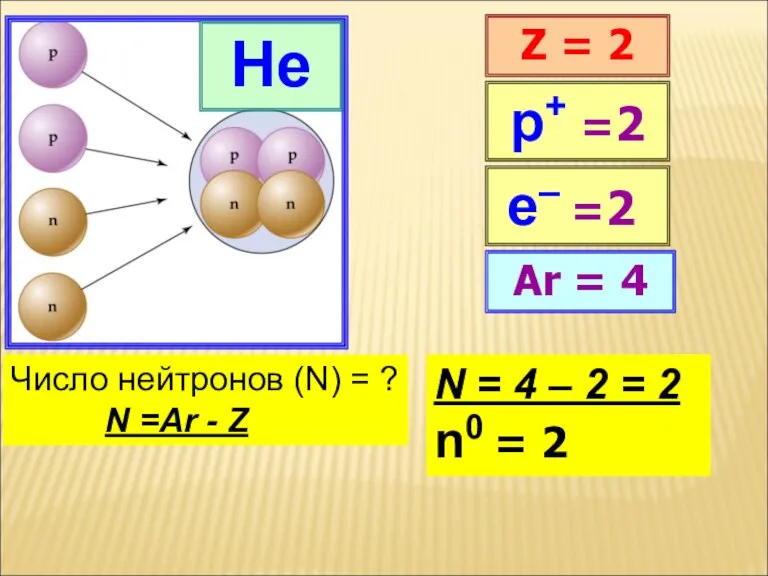
He
Z = 2
Ar = 4
р+ =2
Число нейтронов (N) = ?
N =Ar - Z
N = 4 – 2 = 2
n0 = 2
е– =2
Слайд 11
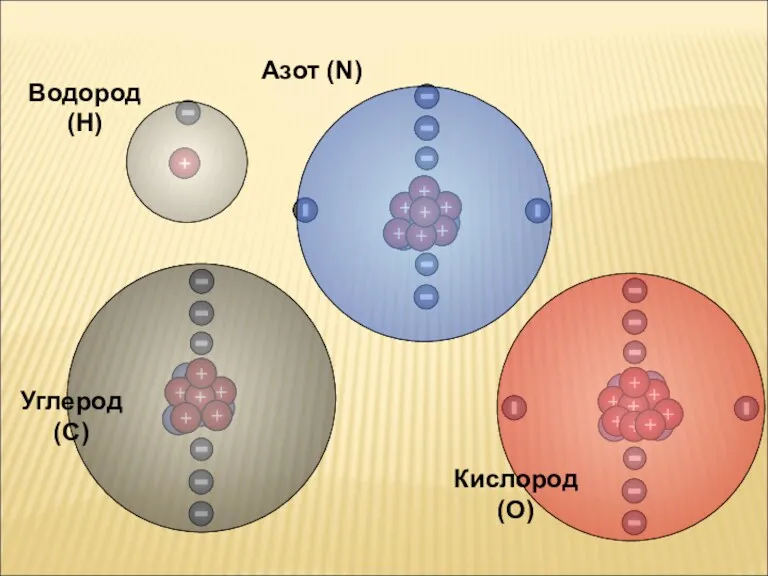
Водород (H)
Азот (N)
Кислород (O)
Углерод (C)
Слайд 12
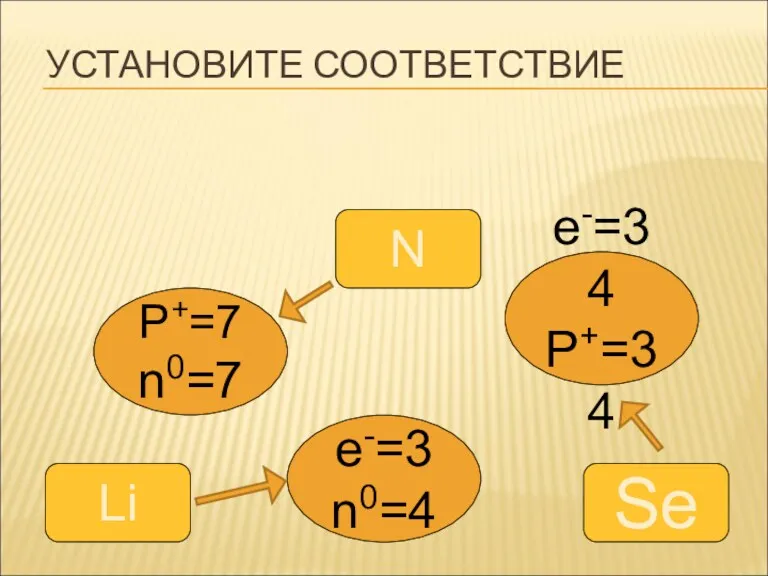
УСТАНОВИТЕ СООТВЕТСТВИЕ
P+=7
n0=7
e-=34
P+=34
e-=3
n0=4
N
Se
Li
Слайд 13

Выводы:
Атом – это сложная система, состоящая из ядра и электронов.
Ядро находится
в центре атома и имеет очень маленький размер, но почти вся масса атома сосредоточена в ядре.
Ядро имеет положительный заряд, величина которого определяется числом протонов в нем.
Электроны движутся вокруг ядра, имеют очень маленькую массу и размеры, обладают отрицательным зарядом.
Атом электронейтрален, число протонов равно числу электронов и равно порядковому номеру элемента.
Слайд 14

ТЕСТОВЫЕ ЗАДАНИЯ
Заряд ядра атома азота равен :
а) 7 б) 13 в)
4 г) 29 д) 11
Число протонов в ядре атома криптона :
а ) 36 б) 17 в) 4 г) 31 д) 6
Число нейтронов в ядре атома цинка :
а) 8 б) 35 в)11 г)30 д)4
Число электронов в атоме железа :
а) 11 б)8 в)56 г)26 д)30
Слайд 15

МОЛОДЦЫ !!!
Вы справились. Желаю дальнейших успехов в изучении химии!
Слайд 16
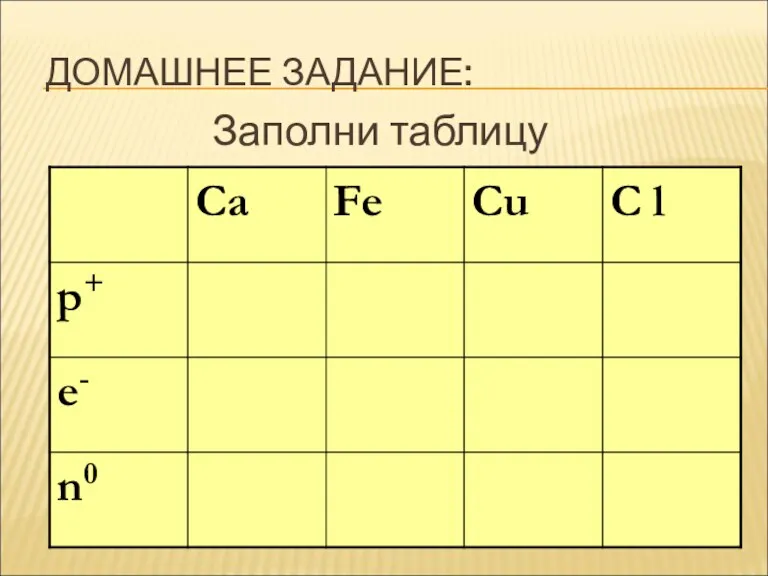
ДОМАШНЕЕ ЗАДАНИЕ:
Заполни таблицу
Слайд 17

У нас осталось немного времени.
Загадайте, пожалуйста, химический элемент.
Его порядковый номер
умножьте на 2.
Прибавьте к этому произведению 5.
Теперь всю сумму умножьте на пять.
Слайд 18

ЗАГАДКИ
Очень положительный
С массою внушительной,
А таких, как он, отряд
Создает в ядре заряд.
Лучший
друг его – нейтрон.
Догадались? Он -….
Слайд 19

Зарядом я похвастать не могу,
А потому сижу в ядре и ни
гу-гу.
А то еще подумают: шпион,
А я нейтральный и зовусь…


















 Средние породы. Типичный андезитовый вулкан
Средние породы. Типичный андезитовый вулкан Учение об агрегатных состояниях вещества. Жидкое состояние. Твердое состояние. Плазма
Учение об агрегатных состояниях вещества. Жидкое состояние. Твердое состояние. Плазма Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров Кремний и его соединения. Нахождение в природе
Кремний и его соединения. Нахождение в природе Неметаллы: общая характеристика
Неметаллы: общая характеристика Гидролиз солей
Гидролиз солей Алкандар,жалпы формуласы, гомологтық қатары, изомерлері, атаулары
Алкандар,жалпы формуласы, гомологтық қатары, изомерлері, атаулары Полимеры, бумага
Полимеры, бумага Залежність фізичних властивостей речовин від типу кристалічних ґраток
Залежність фізичних властивостей речовин від типу кристалічних ґраток Минеральные удобрения
Минеральные удобрения Эпоксидная смола
Эпоксидная смола Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Химия в повседневной жизни человека
Химия в повседневной жизни человека Введение в органическую химию
Введение в органическую химию Ерітіндіден заттарды бөлу әдістері
Ерітіндіден заттарды бөлу әдістері Коллигативные свойства растворов
Коллигативные свойства растворов Коррозия металла. Способы защиты от коррозии
Коррозия металла. Способы защиты от коррозии Техника безопасности и правила работы в лаборатории. 10 класс
Техника безопасности и правила работы в лаборатории. 10 класс Вещества и их превращения Роль химии в нашей жизни
Вещества и их превращения Роль химии в нашей жизни Выделение транс-анетола из эфирных масел
Выделение транс-анетола из эфирных масел Качественные реакции на органические вещества
Качественные реакции на органические вещества Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс Посуда, ее виды и использование
Посуда, ее виды и использование Титриметрические методы количественного определения лекарственных веществ
Титриметрические методы количественного определения лекарственных веществ Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие Неорганические полимеры
Неорганические полимеры Основные классы неорганических соединений
Основные классы неорганических соединений Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты)