Содержание
- 2. Простые вещества металлы и неметаллы .
- 3. Что известно о металлах? Известно 95 элементов Большой атомный радиус Отдают внешние электроны (1 – 3)
- 4. Что известно о неметаллах? Известно 23 элемента Небольшой атомный радиус Принимают внешние электроны (1 – 4)
- 5. Ме неМе (95) (23) Rат Rат ˃ Отдают внешние e̅ Принимают внешние e̅ 1 – 3
- 6. Физические свойства металлов
- 7. 1. Агрегатное состояние Твердые (все Ме, кроме Hg) Жидкая (Hg – ртуть)
- 8. 2. Температура павления Тугоплавкие (tпл > 1000°С) W – вольфрам Легкоплавкие (tпл Hg – ртуть
- 9. 3. Твёрдость Твердые (Cr – хром) Мягкие (Щелочные металлы)
- 10. 4. Плотность Тяжелые (ρ > 5 г/см3) Pb, Hg, Cd Легкие (ρ Al, Li, Mg
- 11. Электропроводность металлов объясняется наличием в их структуре общих свободных электронов 5. Электропроводность Худшая (Hg, Pb, W)
- 12. 6. Теплопроводность Объясняется наличием свободных электронов, которые в результате своего движения обеспечивают быстрое выравнивание температуры металла.
- 13. Объясняется смещением слоев атомов без разрыва химических связей. 7. Ковкость, пластичность, прочность
- 14. Обеспечивается отражающей способностью свободных электронов. 8. Металлический блеск
- 15. Физические свойства неметаллов
- 16. 1. Агрегатное состояние Твердые (C, P, S) Жидкий (Br2 – ртуть) Газы (O2, H2, N2, Cl2,
- 17. 2. Сыпучие, не твёрдые
- 18. 3. Не тепло- и не электропроводные (искл.-С)
- 19. 3. Малая плотность(искл.-С)
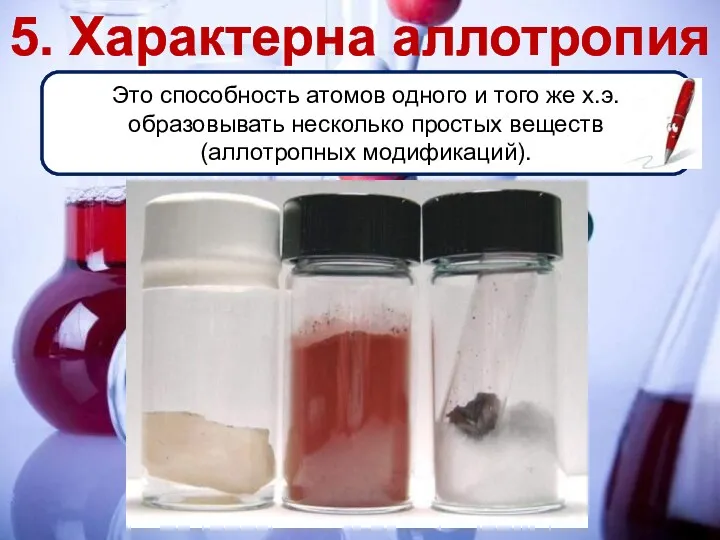
- 20. Это способность атомов одного и того же х.э. образовывать несколько простых веществ (аллотропных модификаций). 5. Характерна
- 21. Причины аллотропии а) разное число атомов в молекуле Р (фосфор красный) О2 (кислород) О3 (озон) Р4
- 22. Причины аллотропии б) образование разных кристаллических форм (С - углерод) Алмаз Графит Уголь
- 23. 6. Металлический блеск Характерен только для графита (С), йода (I2), кремния (Si).
- 25. Скачать презентацию




















 Төменгі фосфориттерден азот – фосфорлы тыңайтқыштар алу технологиясын әзірлеу
Төменгі фосфориттерден азот – фосфорлы тыңайтқыштар алу технологиясын әзірлеу Катализ. Классификация каталитических процессов. Механизм действия катализаторов
Катализ. Классификация каталитических процессов. Механизм действия катализаторов Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации История мыловарения. Моющее действие мыла
История мыловарения. Моющее действие мыла Литий. Физические и химические свойства. Получение и применение
Литий. Физические и химические свойства. Получение и применение Окислительно-восстановительные реакции. Основные положения электронной теории ОВР
Окислительно-восстановительные реакции. Основные положения электронной теории ОВР Расчет реактора установки гидроочистки бензина
Расчет реактора установки гидроочистки бензина Щелочные металлы
Щелочные металлы Коррозия металлов. Классификация коррозионных процессов
Коррозия металлов. Классификация коррозионных процессов Химический состав клетки. Вода
Химический состав клетки. Вода Воспользуйтесь ЛСМ Химические реакции
Воспользуйтесь ЛСМ Химические реакции Кислотність та основність органічних сполук
Кислотність та основність органічних сполук Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Галогенопроизводные углеводородов 1
Галогенопроизводные углеводородов 1 Признаки и условия протекания химических реакций
Признаки и условия протекания химических реакций Удивительные свойства воды
Удивительные свойства воды Гидролиз солей
Гидролиз солей Простые вещества металлы
Простые вещества металлы Хімічні формули речовин
Хімічні формули речовин Минералды тыңайтқыштар өндірісі
Минералды тыңайтқыштар өндірісі История и методология химии. Лекция 8
История и методология химии. Лекция 8 алкадиены
алкадиены Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид The Molecules of Life
The Molecules of Life Кислоты
Кислоты Петрология. Классификации магматических горных пород
Петрология. Классификации магматических горных пород Химия 20 века
Химия 20 века Р-элементы IV Группы Периодической Системы
Р-элементы IV Группы Периодической Системы