Слайд 2

Химические элементы расположены в порядке возрастания (атомных масс) заряда ядра атома.
Горизонтальные
ряды элементов – периоды начинаются щелочным металлом и заканчиваются инертным газом. Периоды бывают малые (1, 2, 3 – по 2 и 8 элементов) и большие (4 -7 по 18 и 32 элемента).
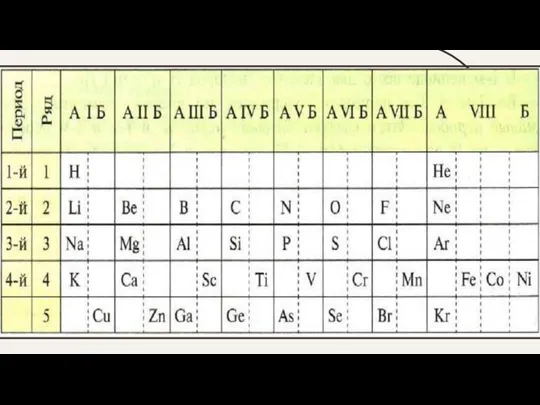
Вертикальные столбцы элементов (сходных по свойствам)называют группами. Группы, которые содержат элементы малых и больших периодов называют главными (А группы), а те которые содержат только элементы больших периодов, называют побочными (Б группы) .
Слайд 3
Слайд 4
Слайд 5
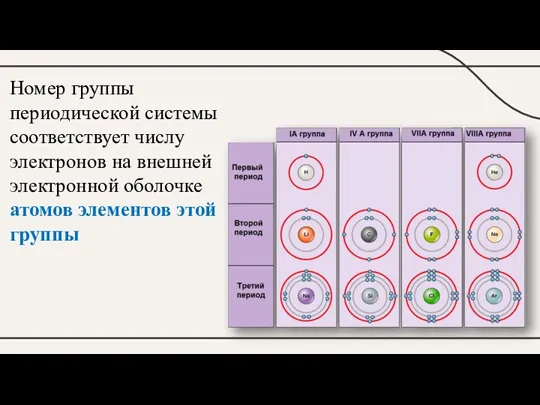
Номер группы периодической системы соответствует числу электронов на внешней электронной оболочке
атомов элементов этой группы
Слайд 6

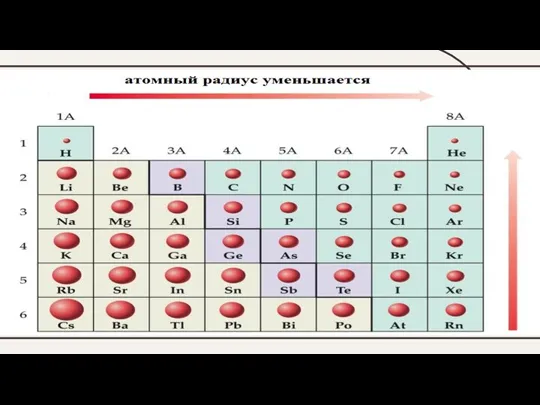
У элементов одного периода при одинаковом числе энергетических уровней в атоме
возрастает (слева направо по периоду) заряд ядра и сила притяжения им электронов ядром. Поэтому:
радиус атома уменьшается;
металлические свойства простых веществ ослабевают;
неметаллические свойства простых веществ усиливаются;
значение относительной электроотрицательности элементов возрастает;
основные свойства высших оксидов и гидроксидов ослабевают;
кислотные свойства высших оксидов и гидроксидов усиливаются.
Слайд 7

Следует подчеркнуть, что закономерности изменения свойств по группам, о которых мы
будем говорить, относятся только к элементам главных подгрупп.
Свойства элементов главной и побочной подгрупп существенно различаются.
Слайд 8

У элементов одной главной подгруппы (А- группы) сверху вниз
- увеличивается
число энергетических уровней в атоме
- уменьшается (ослабевает) сила притяжения электронов ядром
Поэтому:
радиус атома увеличивается;
металлические свойства простых веществ усиливаются;
неметаллические свойства простых веществ ослабевают;
значение относительной электроотрицательности элементов уменьшается;
основные свойства высших оксидов и гидроксидов усиливаются;
кислотные свойства высших оксидов и гидроксидов ослабевают.
Слайд 9

Выберите электронную схему иона калия
А)19Э 2е,8е,8е,1е;
Б)20Э 2е,8е,8е;
В)20Э 2е,8е,8е,2е;
Г)19Э 2е,8е,8е.
Слайд 10

Выберите электронную схему иона химического элемента , расположенного в 3-м периоде,
1-группе
А)2е,8е,8е;
Б) 2е,8е,1е;
В) 2е,6е;
Г) 2е,8е;
Слайд 11











 Полимеры и ЕГЭ
Полимеры и ЕГЭ Химическая кинетика и катализ
Химическая кинетика и катализ Редокс – тепе-теңдік және процестері
Редокс – тепе-теңдік және процестері Непредельные углеводороды
Непредельные углеводороды Медь и сплавы на ее основе
Медь и сплавы на ее основе Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Химическая технология. Введение
Химическая технология. Введение Прикладные аспекты химии поверхностно-активных веществ
Прикладные аспекты химии поверхностно-активных веществ Классификация химических элементов. Периодический закон Д.И. Менделеева
Классификация химических элементов. Периодический закон Д.И. Менделеева Алюминий и его свойства
Алюминий и его свойства Тыңайтқышты тиімді пайдалансақ
Тыңайтқышты тиімді пайдалансақ Бинарные соединения: оксиды, гидриды
Бинарные соединения: оксиды, гидриды Шестичленные гетероциклические соединения с одним и двумя гетероатомами. Конденсированные системы гетероциклов
Шестичленные гетероциклические соединения с одним и двумя гетероатомами. Конденсированные системы гетероциклов Основные понятия и законы химии
Основные понятия и законы химии Химические и физические явления в жизни человека
Химические и физические явления в жизни человека Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Сабын
Сабын 20230419_gidroliz_soley
20230419_gidroliz_soley Поделочные камни
Поделочные камни Основные виды химической связи
Основные виды химической связи Качество топлива и смазочных материалов, эффективность их использования
Качество топлива и смазочных материалов, эффективность их использования Металлы и их соединения
Металлы и их соединения Распределительная хроматография
Распределительная хроматография Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Непредельные углеводороды ряда этилена
Непредельные углеводороды ряда этилена Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их
Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их Щелочноземельные металлы
Щелочноземельные металлы Ароматические углеводороды (арены)
Ароматические углеводороды (арены)