Содержание
- 2. ПРОИСХОЖДЕНИЕ НАЗВАНИЯ Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона
- 3. Аммиак: состав и строение, получение, свойства, применение.
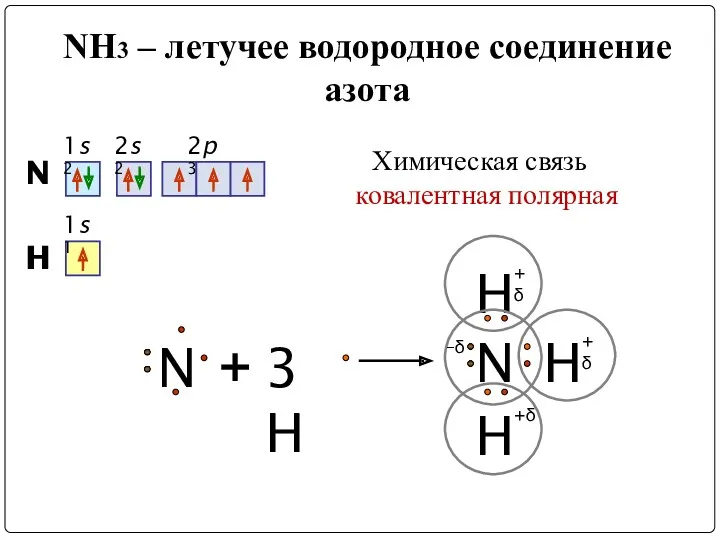
- 4. NH3 – летучее водородное соединение азота N 1s2 2s2 2p3 + H N H H 3H
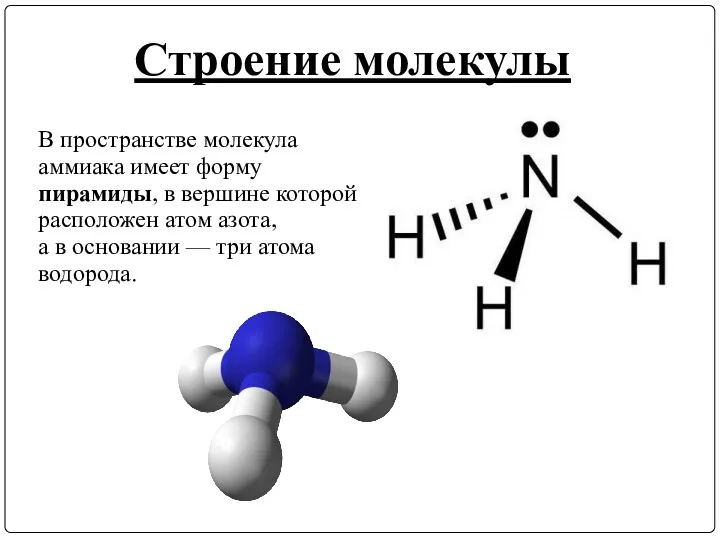
- 5. Строение молекулы В пространстве молекула аммиака имеет форму пирамиды, в вершине которой расположен атом азота, а
- 6. Получение В промышленности аммиак получают прямым синтезом из простых веществ: N2 + 3H2 2NH3 + Q
- 7. Так как реакция экзотермическая и протекает с уменьшением объёма, то проводить её нужно при более низких
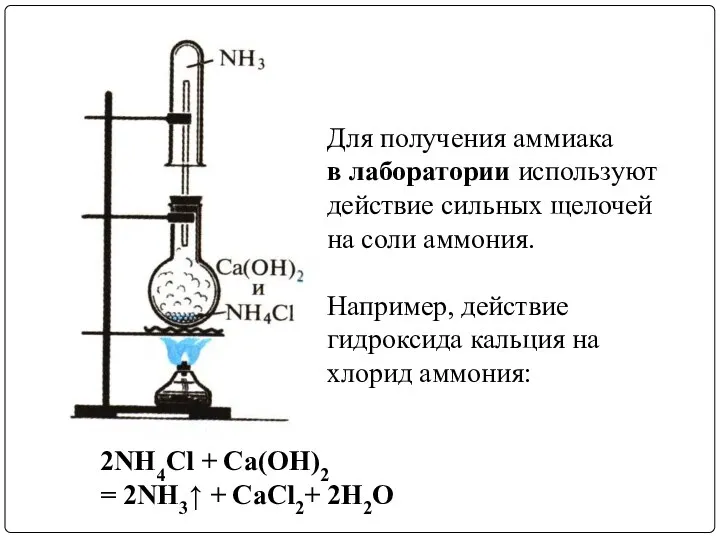
- 8. 2NH4Cl + Ca(OH)2 = 2NH3↑ + СaCl2+ 2H2O Для получения аммиака в лаборатории используют действие сильных
- 9. Физические свойства бесцветный газ с резким запахом легче воздуха (М=17 г/моль) хорошо растворяется в воде -700
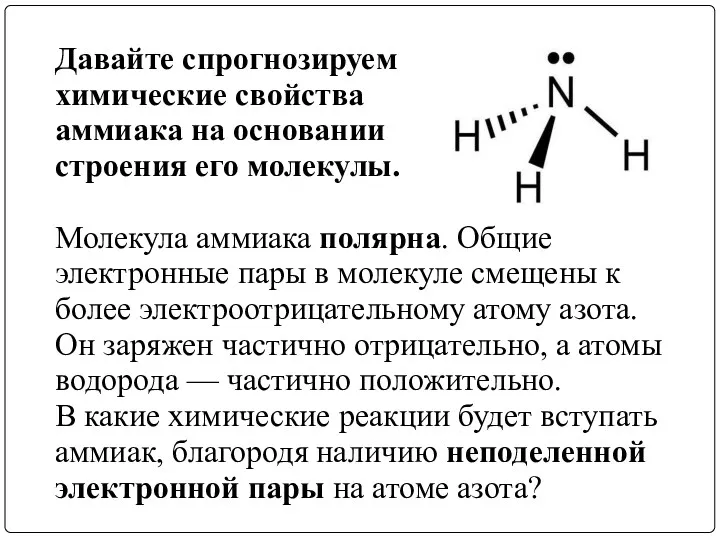
- 10. Давайте спрогнозируем химические свойства аммиака на основании строения его молекулы. Молекула аммиака полярна. Общие электронные пары
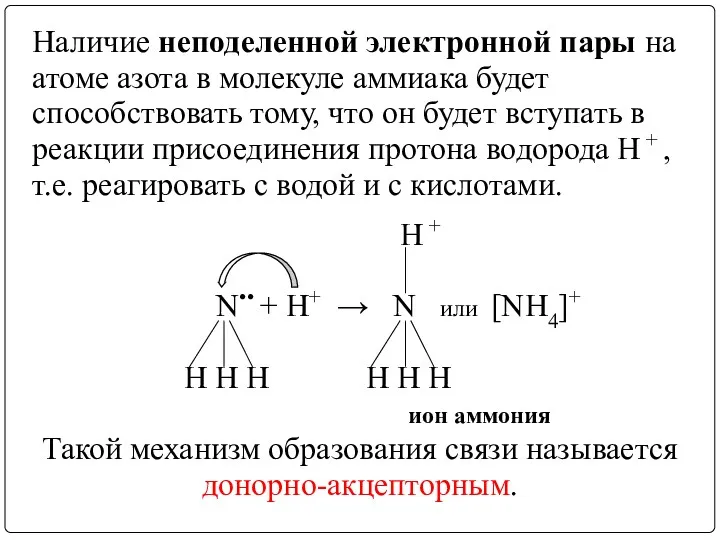
- 11. Наличие неподеленной электронной пары на атоме азота в молекуле аммиака будет способствовать тому, что он будет
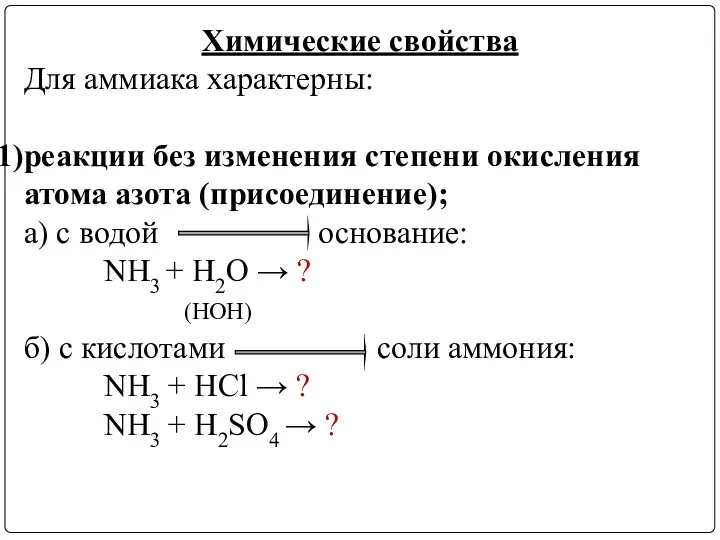
- 12. Химические свойства Для аммиака характерны: реакции без изменения степени окисления атома азота (присоединение); а) с водой
- 13. Добрый старый аммиак, Он богач, и он добряк, Богат неподелёнными Своими электронами, Но только, вот беда,
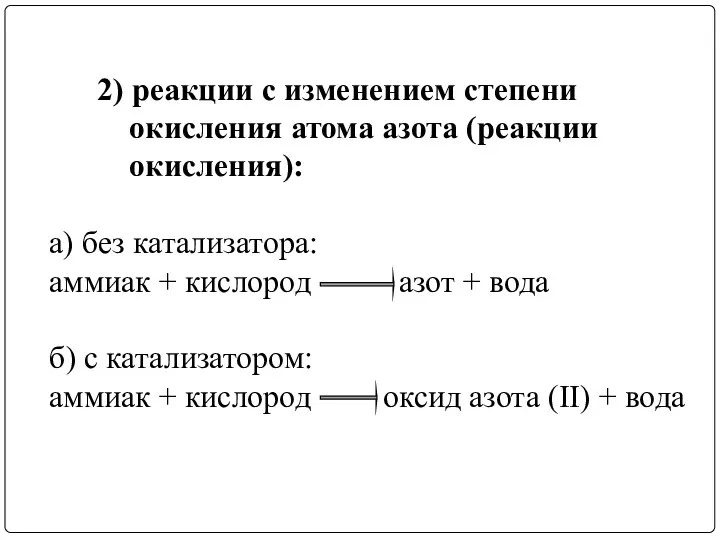
- 14. 2) реакции с изменением степени окисления атома азота (реакции окисления): а) без катализатора: аммиак + кислород
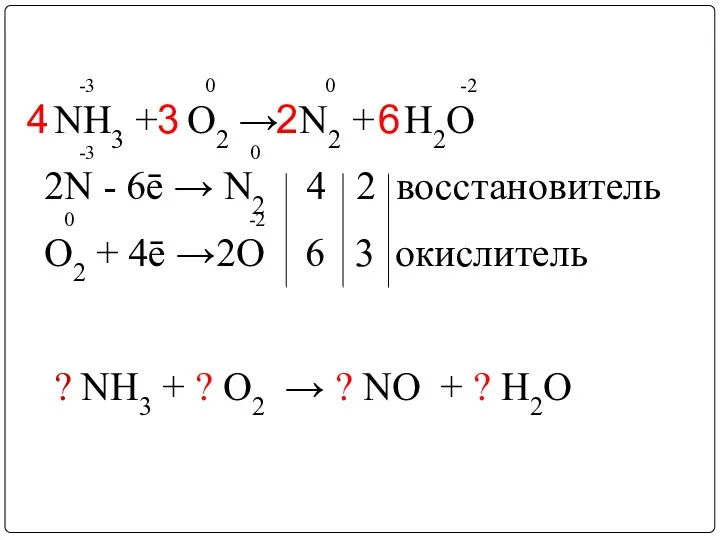
- 15. -3 0 0 -2 NH3 + O2 → N2 + H2O -3 0 2N - 6ē
- 16. Применение Аммиак используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров,
- 19. Скачать презентацию








 Изомерия биоорганических соединений. Структура и функции биолекул
Изомерия биоорганических соединений. Структура и функции биолекул Медь и её соединения
Медь и её соединения Атом - сложная частица
Атом - сложная частица Лабораторные исследования состава и физико-химических свойств нефти
Лабораторные исследования состава и физико-химических свойств нефти Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки
Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки Молярный объем газов
Молярный объем газов Вуглеводи
Вуглеводи Планетарная модель строения атома
Планетарная модель строения атома Технология промышленных газов
Технология промышленных газов Алюминий. Схема расположения электронов на энергетических подуровнях
Алюминий. Схема расположения электронов на энергетических подуровнях Гидроочистка дизельного топлива
Гидроочистка дизельного топлива Материаловедение, как отрасль науки
Материаловедение, как отрасль науки Кремний и его соединения
Кремний и его соединения Типы химических реакций
Типы химических реакций Взаємодія кисеню зі складними речовинами
Взаємодія кисеню зі складними речовинами Химическая связь
Химическая связь Общая характеристика неметаллов
Общая характеристика неметаллов Значення періодичного закону
Значення періодичного закону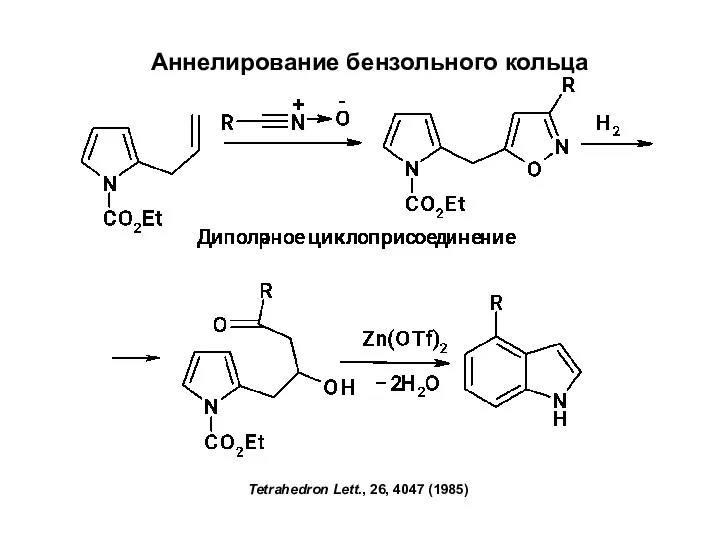 Аннелирование бензольного кольца
Аннелирование бензольного кольца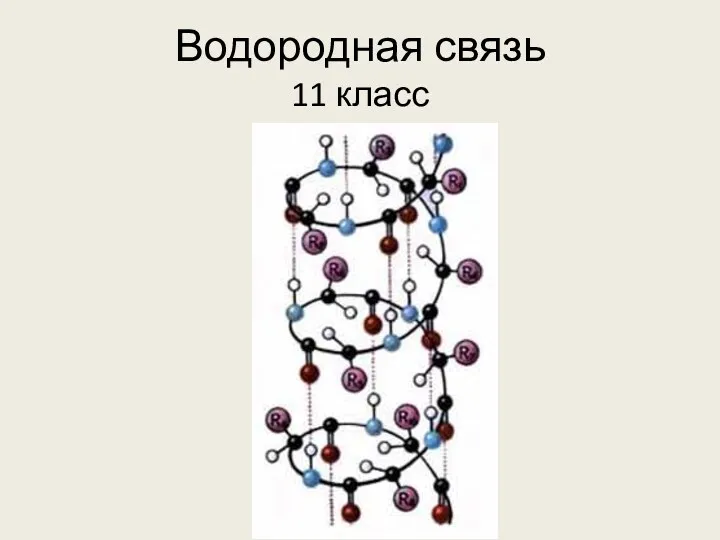 Водородная связь
Водородная связь Періодичний закон Д.І. Менделєєва. Періодична система хімічних елементів, її структура
Періодичний закон Д.І. Менделєєва. Періодична система хімічних елементів, її структура Органические соединения серы
Органические соединения серы Проектная работа. Косметика своими руками
Проектная работа. Косметика своими руками Методы окислительно-восстановительного и комплексонометри-ческого титрования
Методы окислительно-восстановительного и комплексонометри-ческого титрования Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Алотропні модифікації фосфору
Алотропні модифікації фосфору Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша)
Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша) Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу