Содержание
- 2. Циклоалканы – предельные циклические (алициклические) углеводороды. Общая формула циклоалканов – CnH2n
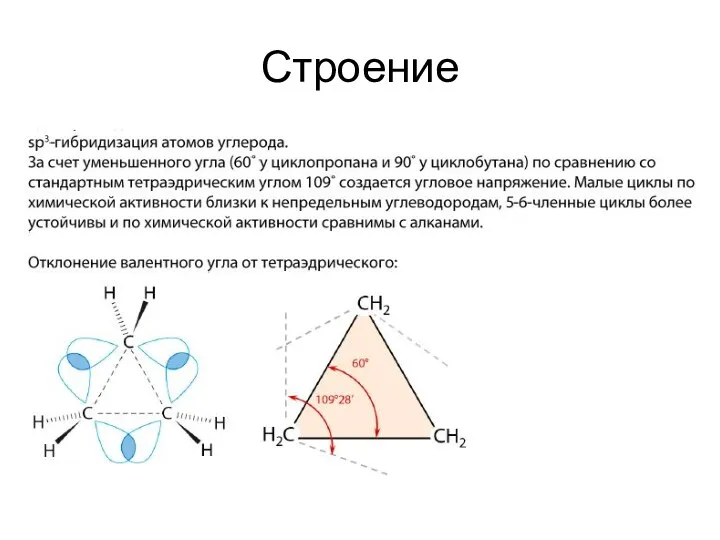
- 4. Строение
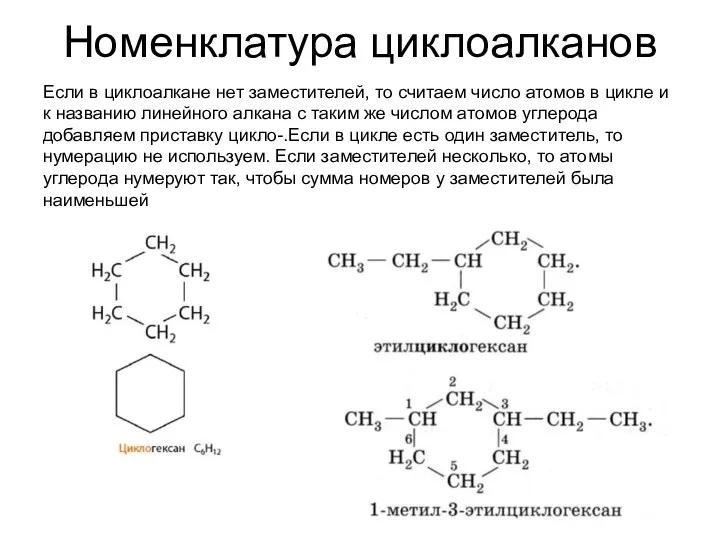
- 5. Номенклатура циклоалканов Если в циклоалкане нет заместителей, то считаем число атомов в цикле и к названию
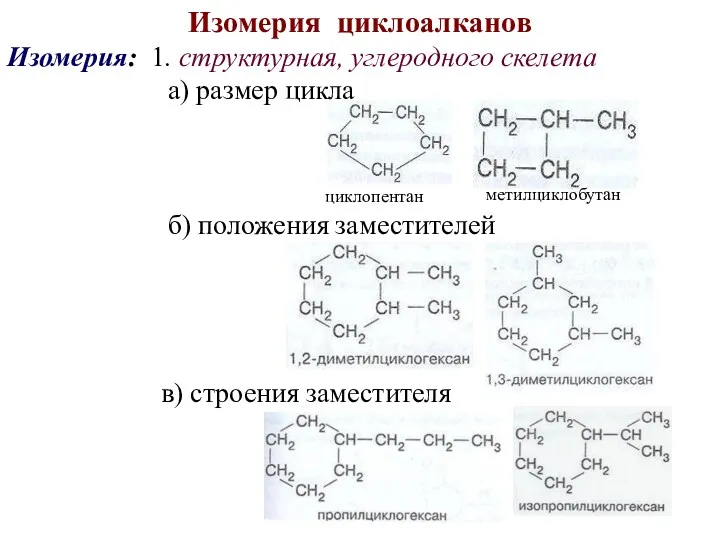
- 6. Изомерия циклоалканов Изомерия: 1. структурная, углеродного скелета а) размер цикла б) положения заместителей в) строения заместителя
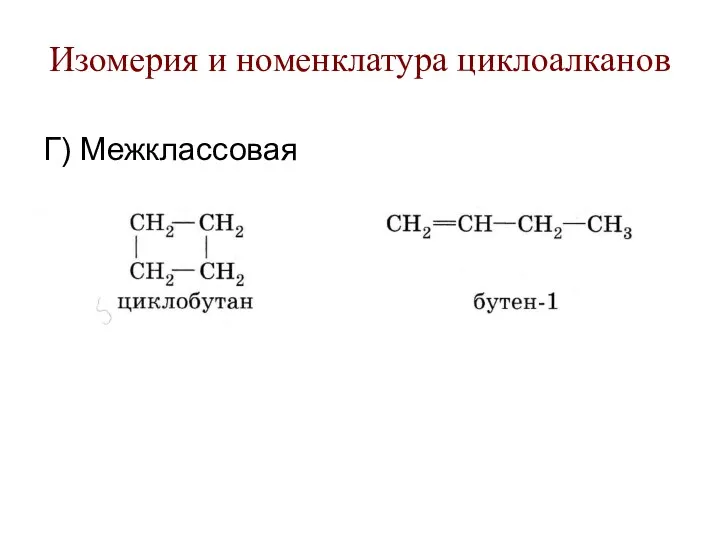
- 7. Изомерия и номенклатура циклоалканов Г) Межклассовая
- 8. Физические свойства При обычных условиях первые два члена ряда (С3 — С4) — газы, (С5 —
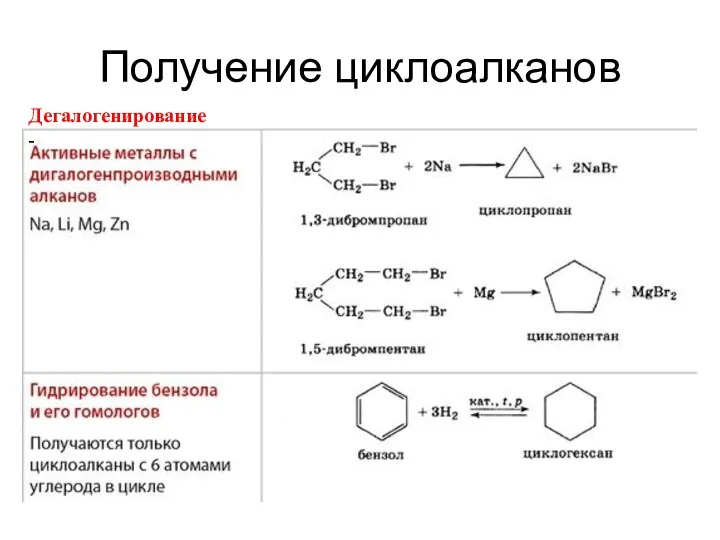
- 9. Получение циклоалканов Дегалогенирование -
- 10. Химические свойства Свойства малых циклов: Малые циклы про себя можно назвать «алкеновыми», так как для них
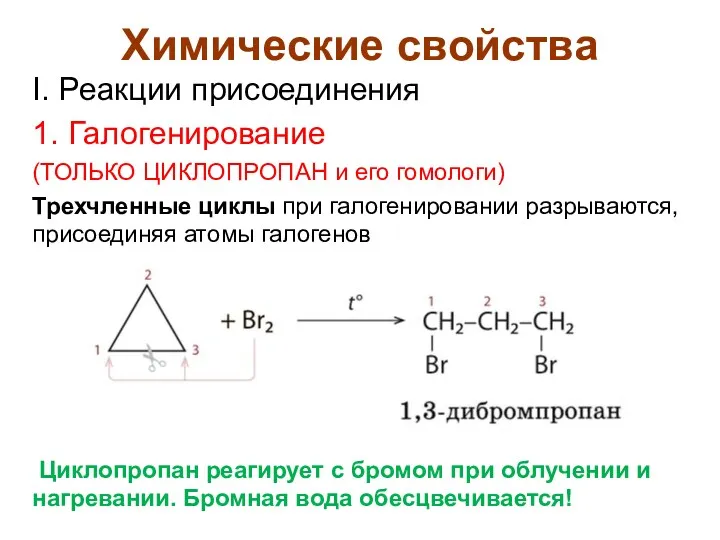
- 11. Химические свойства I. Реакции присоединения 1. Галогенирование (ТОЛЬКО ЦИКЛОПРОПАН и его гомологи) Трехчленные циклы при галогенировании
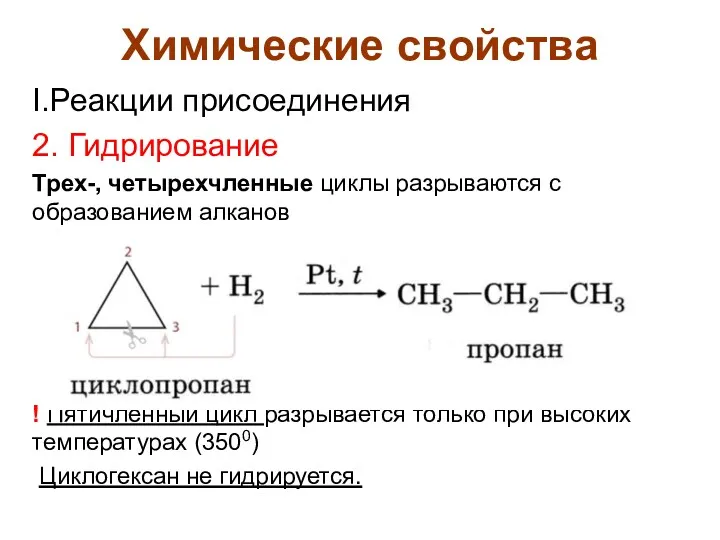
- 12. Химические свойства I.Реакции присоединения 2. Гидрирование Трех-, четырехчленные циклы разрываются с образованием алканов ! Пятичленный цикл
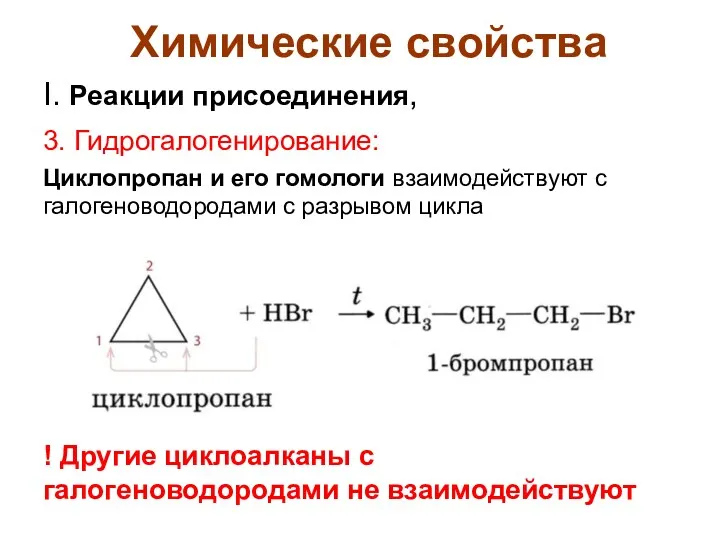
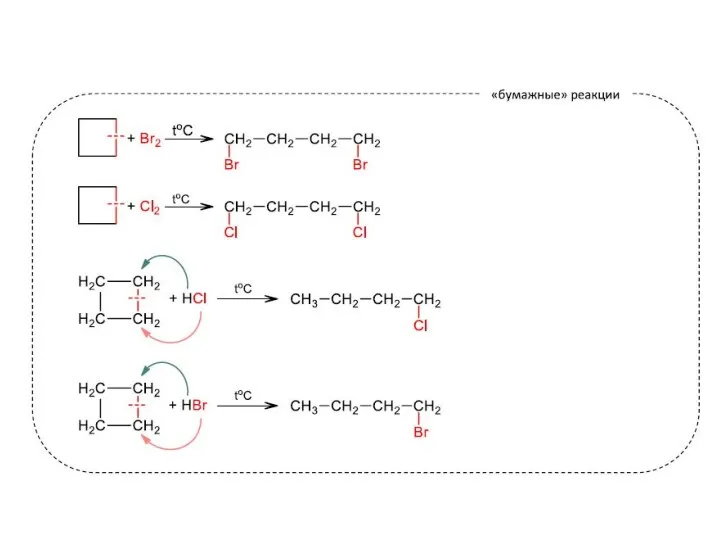
- 13. Химические свойства I. Реакции присоединения, 3. Гидрогалогенирование: Циклопропан и его гомологи взаимодействуют с галогеноводородами с разрывом
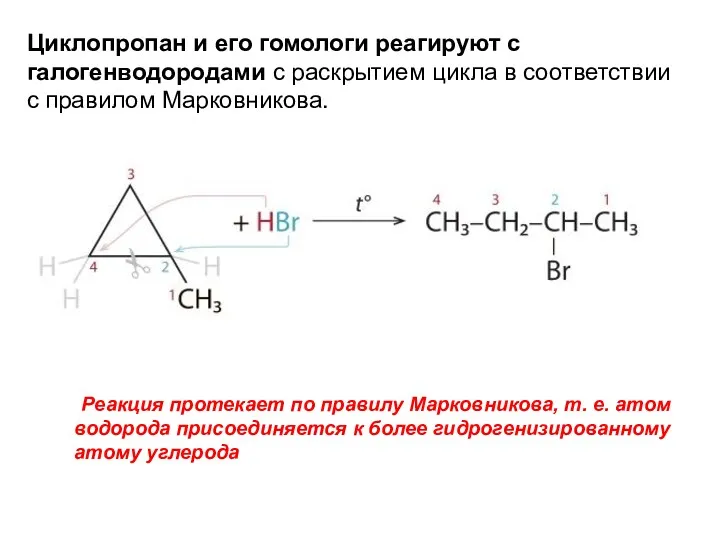
- 14. Циклопропан и его гомологи реагируют с галогенводородами с раскрытием цикла в соответствии с правилом Марковникова. Реакция
- 16. Химические свойства II. Свойства средних циклов. Средние циклы про себя можно назвать «алкановыми», так как для
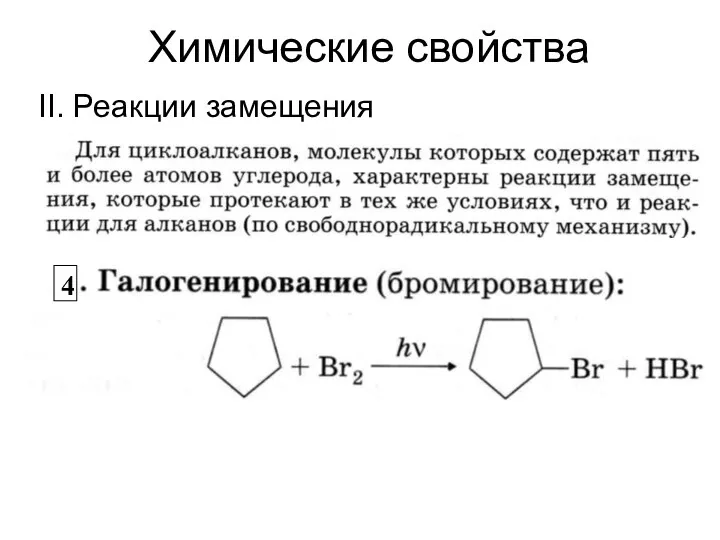
- 17. Химические свойства II. Реакции замещения 4
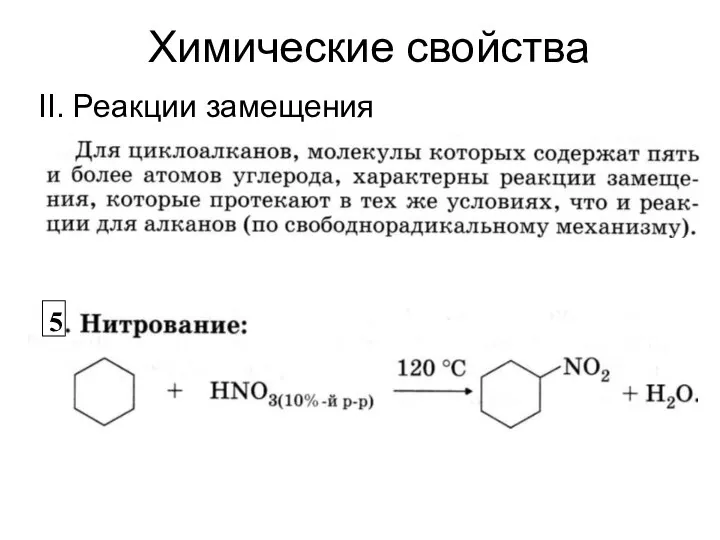
- 18. Химические свойства II. Реакции замещения 5
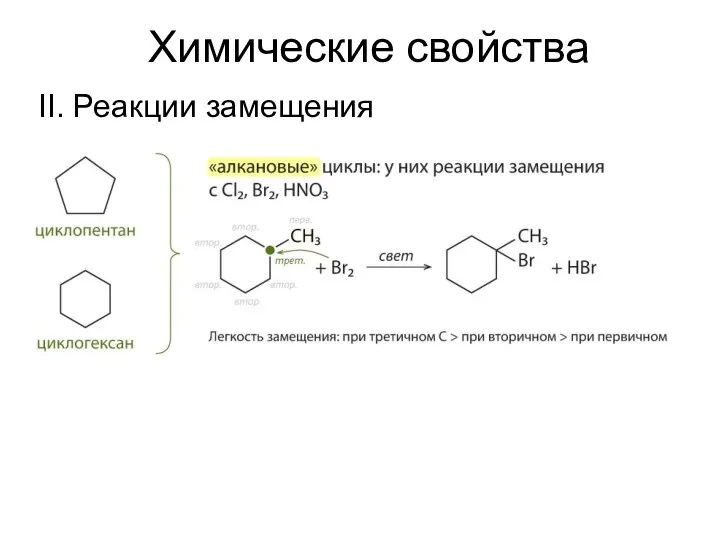
- 19. Химические свойства II. Реакции замещения
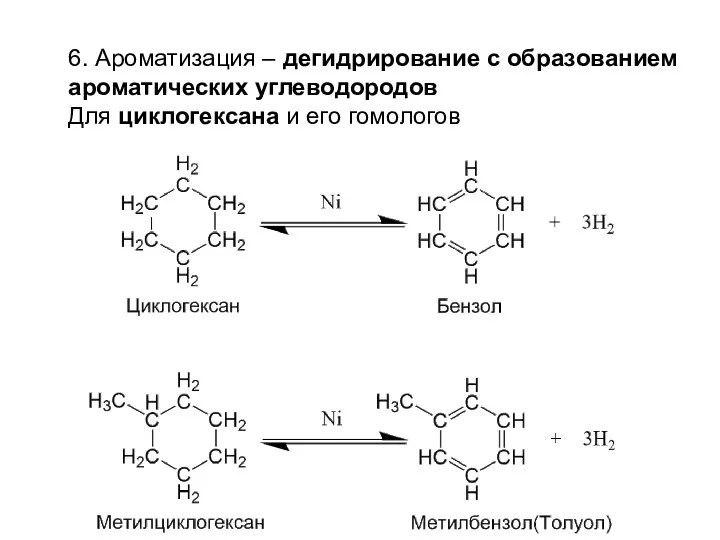
- 20. 6. Ароматизация – дегидрирование с образованием ароматических углеводородов Для циклогексана и его гомологов
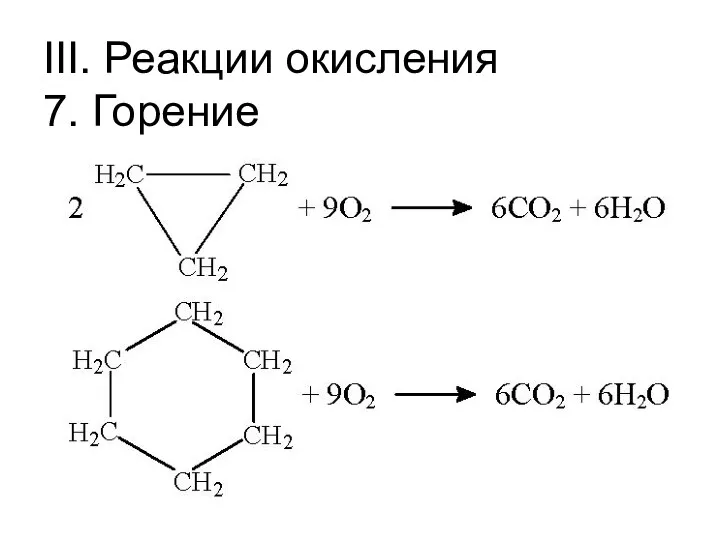
- 21. III. Реакции окисления 7. Горение
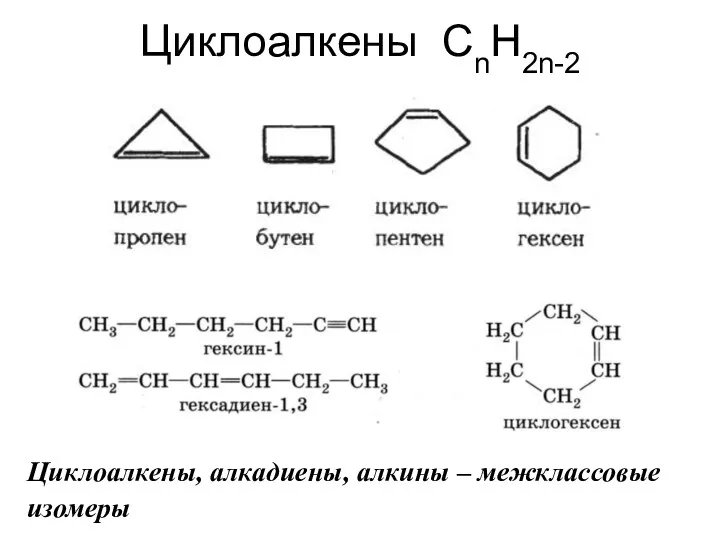
- 22. Циклоалкены CnH2n-2 Циклоалкены, алкадиены, алкины – межклассовые изомеры
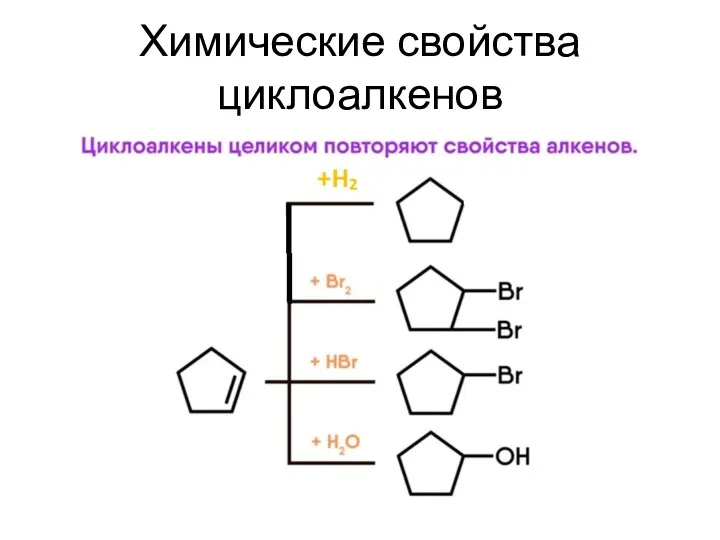
- 23. Химические свойства циклоалкенов
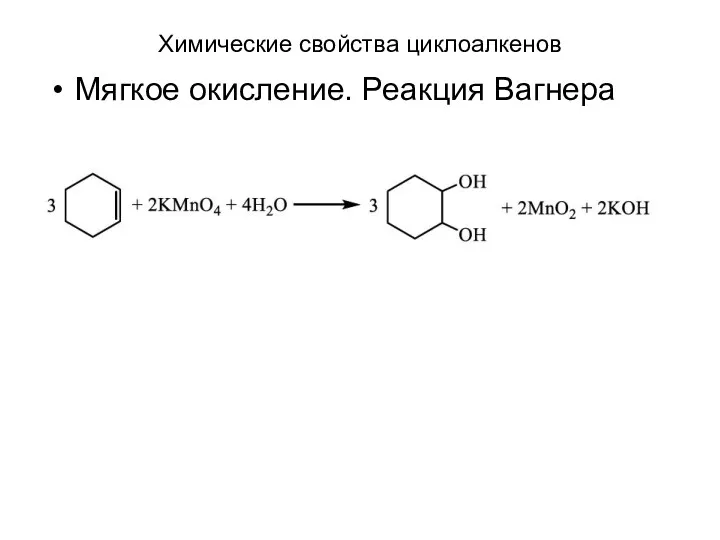
- 24. Химические свойства циклоалкенов Мягкое окисление. Реакция Вагнера
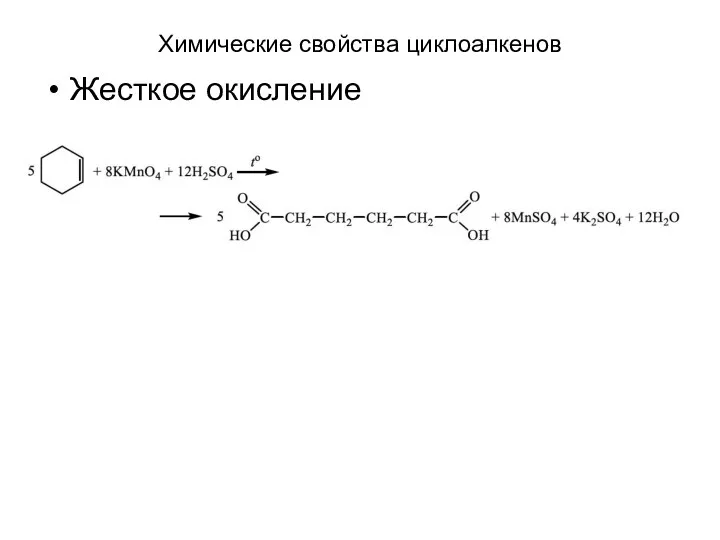
- 25. Химические свойства циклоалкенов Жесткое окисление
- 27. Скачать презентацию





 Металдар коррозиясы және онымен күресу шаралары
Металдар коррозиясы және онымен күресу шаралары Главные подгруппы металлов I-III групп в таблице Д.И. Менделеева
Главные подгруппы металлов I-III групп в таблице Д.И. Менделеева Полимеры
Полимеры Идеал газ. Молекулалы-кинетикалық теорияның негізгі теңдеуі. Молекулалық орташа квадраттық жылдамдығына есептер шығару
Идеал газ. Молекулалы-кинетикалық теорияның негізгі теңдеуі. Молекулалық орташа квадраттық жылдамдығына есептер шығару Водород
Водород Анализ и синтез химических веществ
Анализ и синтез химических веществ 20231004_agregatnye_sostoyaniya_-_kopiya
20231004_agregatnye_sostoyaniya_-_kopiya Водород. Распространенность в природе
Водород. Распространенность в природе Открытие новых химических элементов с атомными номерами 113, 115, 117 и 118
Открытие новых химических элементов с атомными номерами 113, 115, 117 и 118 Теплова теорія припинення горіння. Вогнегасні засоби
Теплова теорія припинення горіння. Вогнегасні засоби Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Молярна маса речовини
Молярна маса речовини Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс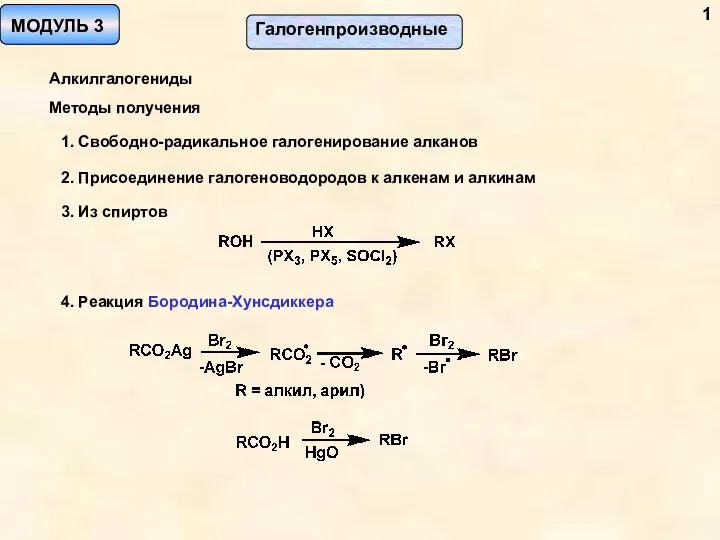 Галогенпроизводные. Алкилгалогениды. Методы получения. (Модуль 3)
Галогенпроизводные. Алкилгалогениды. Методы получения. (Модуль 3) Люминесцентный анализ
Люминесцентный анализ Неметаллы VА группы
Неметаллы VА группы Сера и ее соединения
Сера и ее соединения Классификация химических элементов
Классификация химических элементов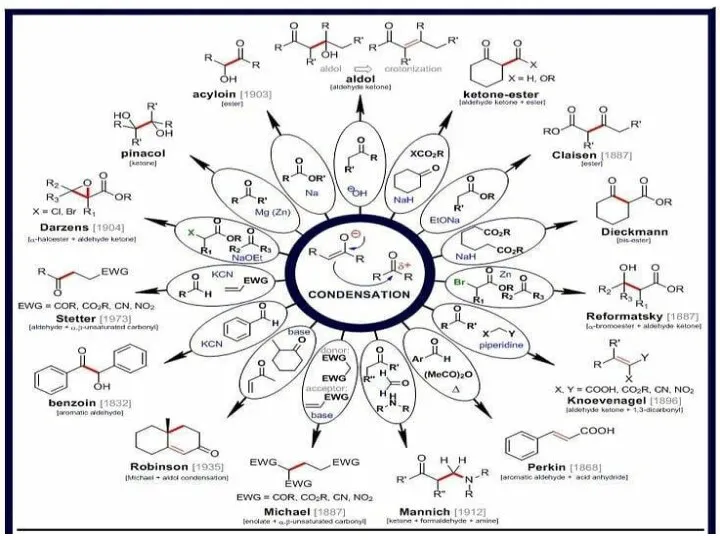 Альдольные реакции енолятов
Альдольные реакции енолятов Автомобильные бензины
Автомобильные бензины Железо и его соединения
Железо и его соединения Лекция 8. Электрохимия
Лекция 8. Электрохимия Химическое загрязнение атмосферы
Химическое загрязнение атмосферы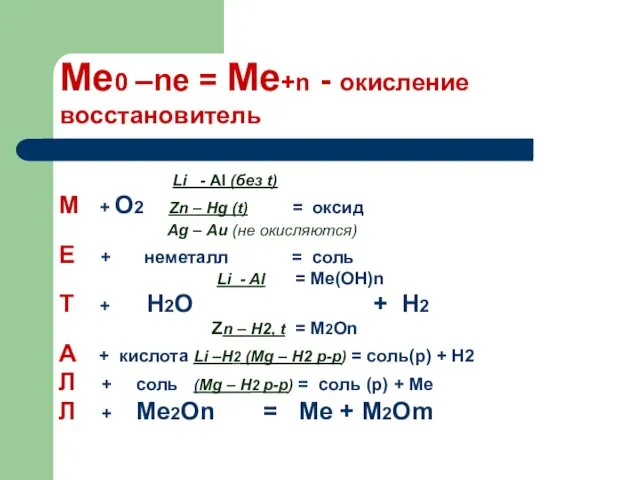 Коррозия металлов
Коррозия металлов Экспресс-методы решения задач по химии
Экспресс-методы решения задач по химии Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9
Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9 Липиды. Классификация липидов
Липиды. Классификация липидов